
- •Техника безопасности
- •1. Электропроводность растворов электролитов
- •Электропроводность растворов электролитов
- •Удельная электропроводность
- •Кондуктометрическое титрование
- •Определение растворимости труднорастворимой соли.
- •Работа 1.1. Определение концентрационной зависимости удельной и молярной электропроводности сильного электролита
- •Порядок выполнения работы:
- •Работа 1.2. Определение константы диссоциации слабого электролита методом электропроводности
- •Порядок выполнения работы:
- •Работа 1.3. Кондуктометрическое титрование
- •Порядок выполнения работы:
- •Работа 1.4. Кондуктометрическое определение термодинамических параметров растворения труднорастворимого соединения
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
- •2. Электродвижущие силы Возникновение потенциалов на границах фаз.
- •Электродный потенциал
- •Водородный электрод
- •Измерение электродных потенциалов
- •Электрохимический (гальванический) элемент
- •Концентрационный гальванический элемент
- •Измерение эдс гальванического элемента компенсационным методом
- •Температурная зависимость эдс.
- •Электроды сравнения
- •Хлорсеребряный электрод
- •Окислительно-восстановительные электроды и их потенциалы
- •Мембранные равновесия. Стеклянный электрод
- •Кислотно-основные буферные системы
- •Механизм буферного действия
- •Буферная емкость
- •Порядок выполнения работы:
- •Порядок выполнения работы:
- •Порядок выполнения работы:
- •Окислительно-восстановительных потенциалов
- •Порядок выполнения работы:
- •Буферной ёмкости буферных систем
- •Порядок выполнения работы:
- •Порядок выполнения работы:
- •Контрольные вопросы Перед выполнением работы:
- •К защите работы:
- •3. Адсорбция
- •Метод полных концентраций
- •Термодинамика адсорбции по Гиббсу
- •Уравнение адсорбции Гиббса
- •Адсорбция из жидких растворов на поверхности твердых адсорбентов
- •Теплоты адсорбции
- •Работа 3.1. Изучение адсорбции паров воды на твердом адсорбенте
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
- •Работа 3.2. Изучение адсорбции уксусной кислоты из водного раствора на активированном угле
- •Интерферометрический метод анализа концентрации растворов.
- •Технология проведения адсорбции и методика определения равновесных концентраций растворов и расчета адсорбции по результатам эксперимента:
- •Перед выполнением работы:
- •К защите работы:
- •Работа 3.3. Изучение адсорбции поверхностно-активных веществ (пав) на границе воздух-раствор
- •Измерение поверхностного натяжения жидкостей методом Ребиндера.
- •Расчет адсорбции на границе раздела водный раствор – воздух.
- •Порядок выполнения работы:
- •Проверка выполнимости правила Дюкло – Траубе
- •Перед выполнением работы:
- •К защите работы:
- •4. Газовая хроматография
- •Общие сведения о газовом хроматографе
- •Детекторы
- •Детектор по теплопроводности (дтп)
- •Пламенно-ионизационный детектор (пид)
- •Качественный и количественный анализ в газовой хроматографии.
- •Определение мольных теплот растворения газов и паров в жидкостях газохроматографическим методом
- •Порядок работы на хроматографе лхм-80
- •Работа 4.1. Качественный и количественный анализ смеси углеводородов с помощью газовой хроматографии на колонке с апьезоном, нанесенным на хроматон.
- •Определение качественного состава смеси углеводородов по совпадению времен удерживания компонентов контрольной смеси с временами удерживания углеводородов c6 - с9 .
- •Расчет поправочных коэффициентов для углеводородов c6 - с9 и определение количественного состава контрольной смеси углеводородов в мольных процентах.
- •Перед выполнением работы:
- •К защите работы:
- •Работа 4.2. Определение мольных теплот растворения нормальных углеводородов c6- c9 в апьезоне хроматографическим методом
- •Перед выполнением работы:
- •К защите работы:
- •Работа 4.3. Определение индексов ковача веществ и их температурных коэффициентов на апьезоне
- •Перед выполнением работы:
- •К защите работы:
- •Химическая кинетика
- •Кинетические уравнения реакций различных порядков Реакции нулевого порядка
- •Реакции первого порядка
- •Реакции второго порядка
- •Реакции n-го порядка
- •Способы определения порядков реакции.
- •Зависимость скорости реакции от температуры
- •Сложные реакции
- •Работа 5.1. Кинетика омыления этилацетата в присутствии ионов гидроксила.
- •Порядок выполнения работы:
- •Определение æ0.
- •Определение константы скорости реакции при разных температурах.
- •Определение энергии активации и предэкспоненциального множителя.
- •Перед выполнением работы:
- •К защите работы:
- •Работа 5.2. Изучение кинетики гомогенно-каталитического разложения н2о2 .
- •Порядок подготовки установки к работе и работа на ней.
- •Порядок проведения кинетических опытов:
- •Варианты задания и методика расчетов.
- •Изучение зависимости скорости реакции разложения перекиси водорода от концентрации катализатора.
- •Влияние начальной концентрации н2о2 на период полупревращения. Определение порядка реакции.
- •III. Определение константы равновесия и константы скорости реакции разложения перекиси водорода.
- •Перед выполнением работы:
- •К защите работы:
- •Работа 5.3. Изучение кинетики инверсии сахарозы.
- •Методика измерения угла вращения на поляриметре (сахариметре)
- •Методика измерения угла вращения на автоматическом поляриметре
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
- •Работа 5.4. Изучение кинетики реакции окисления иодид-ионов ионами трёхвалентного железа фотометрическим методом
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
Кинетические уравнения реакций различных порядков Реакции нулевого порядка
Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
![]() 5.9
5.9
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
Реакции первого порядка
Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка А ––> В. Реакции первого порядка характеризуются кинетическим уравнением вида:
![]() 5.10
5.10
Пусть в объеме V в начальный момент времени находилось а молей исходного вещества (С0), за время τ происходит превращение х молей этого вещества, следовательно, к моменту τ его остается (а-х) молей (Сτ=С), тогда
![]() и
и
![]()
Поскольку
![]() ,
то после разделения переменных и
интегрирования получаем:
,
то после разделения переменных и
интегрирования получаем:
![]() и
и
![]() 5.11
5.11
либо
![]() 5.11*
5.11*
Рис 5.3 Зависимость логарифма концентрации от времени для реакций первого порядка
|
Т.о., логарифм концентрации для реакции первого порядка линейно зависит от времени (рис. 5.3) и константа скорости численно равна тангенсу угла наклона прямой к оси времени.
|
Размерность константы: к1=τ-1=[с-1; мин-1,…]
Еще одной кинетической характеристикой реакции является период полупревращения τ1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Учитывая, что С = ½Со:
![]() 5.12
5.12
Как видно из полученного выражения, период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества.
Реакции второго порядка
Для
реакций второго порядка кинетическое
уравнение имеет следующий вид:
![]() 5.13
5.13
либо
![]() 5.14
5.14
Рассмотрим простейший случай, когда кинетическое уравнение имеет вид (5.13) или, что то же самое, в уравнении вида (5.14) концентрации исходных веществ одинаковы. Пусть в объеме V в начальный момент времени находилось а молей исходного вещества (С0), за время τ происходит превращение х молей этого вещества, следовательно, к моменту τ его остается (а-х) молей (Сτ=С), тогда
![]() 5.15
5.15
После разделения переменных и интегрирования получаем:
![]() или
или
![]() 5.16
5.16
Т.о., для реакций второго порядка, имеющих кинетическое уравнение вида (5.13), характерна линейная зависимость обратной концентрации от времени (рис. 5.4) и константа скорости равна тангенсу угла наклона прямой к оси времени:
|
|
Период
полупревращения равен:
![]() 5.16
5.16
Если начальные концентрации реагирующих веществ Cо,А=и Cо,В различны, то константу скорости реакции находят интегрированием уравнения (5.17), в котором а и в – числа молей веществ в начальный момент, а (а-х) и (в-х) - в момент времени τ от начала реакции:
![]() 5.17
5.17
В этом случае для константы скорости получаем выражение:
![]() 5.18
5.18
Размерность константы: к2=τ-1С-1 =[л·моль-1·с-1; л·моль-1· мин-1,…]

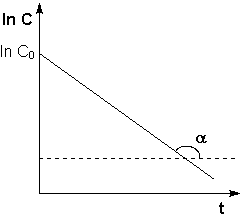
 Рис. 5.4 Зависимость обратной
концентрации от времени для
реакций
второго порядка
Рис. 5.4 Зависимость обратной
концентрации от времени для
реакций
второго порядка