
- •Техника безопасности
- •1. Электропроводность растворов электролитов
- •Электропроводность растворов электролитов
- •Удельная электропроводность
- •Кондуктометрическое титрование
- •Определение растворимости труднорастворимой соли.
- •Работа 1.1. Определение концентрационной зависимости удельной и молярной электропроводности сильного электролита
- •Порядок выполнения работы:
- •Работа 1.2. Определение константы диссоциации слабого электролита методом электропроводности
- •Порядок выполнения работы:
- •Работа 1.3. Кондуктометрическое титрование
- •Порядок выполнения работы:
- •Работа 1.4. Кондуктометрическое определение термодинамических параметров растворения труднорастворимого соединения
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
- •2. Электродвижущие силы Возникновение потенциалов на границах фаз.
- •Электродный потенциал
- •Водородный электрод
- •Измерение электродных потенциалов
- •Электрохимический (гальванический) элемент
- •Концентрационный гальванический элемент
- •Измерение эдс гальванического элемента компенсационным методом
- •Температурная зависимость эдс.
- •Электроды сравнения
- •Хлорсеребряный электрод
- •Окислительно-восстановительные электроды и их потенциалы
- •Мембранные равновесия. Стеклянный электрод
- •Кислотно-основные буферные системы
- •Механизм буферного действия
- •Буферная емкость
- •Порядок выполнения работы:
- •Порядок выполнения работы:
- •Порядок выполнения работы:
- •Окислительно-восстановительных потенциалов
- •Порядок выполнения работы:
- •Буферной ёмкости буферных систем
- •Порядок выполнения работы:
- •Порядок выполнения работы:
- •Контрольные вопросы Перед выполнением работы:
- •К защите работы:
- •3. Адсорбция
- •Метод полных концентраций
- •Термодинамика адсорбции по Гиббсу
- •Уравнение адсорбции Гиббса
- •Адсорбция из жидких растворов на поверхности твердых адсорбентов
- •Теплоты адсорбции
- •Работа 3.1. Изучение адсорбции паров воды на твердом адсорбенте
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
- •Работа 3.2. Изучение адсорбции уксусной кислоты из водного раствора на активированном угле
- •Интерферометрический метод анализа концентрации растворов.
- •Технология проведения адсорбции и методика определения равновесных концентраций растворов и расчета адсорбции по результатам эксперимента:
- •Перед выполнением работы:
- •К защите работы:
- •Работа 3.3. Изучение адсорбции поверхностно-активных веществ (пав) на границе воздух-раствор
- •Измерение поверхностного натяжения жидкостей методом Ребиндера.
- •Расчет адсорбции на границе раздела водный раствор – воздух.
- •Порядок выполнения работы:
- •Проверка выполнимости правила Дюкло – Траубе
- •Перед выполнением работы:
- •К защите работы:
- •4. Газовая хроматография
- •Общие сведения о газовом хроматографе
- •Детекторы
- •Детектор по теплопроводности (дтп)
- •Пламенно-ионизационный детектор (пид)
- •Качественный и количественный анализ в газовой хроматографии.
- •Определение мольных теплот растворения газов и паров в жидкостях газохроматографическим методом
- •Порядок работы на хроматографе лхм-80
- •Работа 4.1. Качественный и количественный анализ смеси углеводородов с помощью газовой хроматографии на колонке с апьезоном, нанесенным на хроматон.
- •Определение качественного состава смеси углеводородов по совпадению времен удерживания компонентов контрольной смеси с временами удерживания углеводородов c6 - с9 .
- •Расчет поправочных коэффициентов для углеводородов c6 - с9 и определение количественного состава контрольной смеси углеводородов в мольных процентах.
- •Перед выполнением работы:
- •К защите работы:
- •Работа 4.2. Определение мольных теплот растворения нормальных углеводородов c6- c9 в апьезоне хроматографическим методом
- •Перед выполнением работы:
- •К защите работы:
- •Работа 4.3. Определение индексов ковача веществ и их температурных коэффициентов на апьезоне
- •Перед выполнением работы:
- •К защите работы:
- •Химическая кинетика
- •Кинетические уравнения реакций различных порядков Реакции нулевого порядка
- •Реакции первого порядка
- •Реакции второго порядка
- •Реакции n-го порядка
- •Способы определения порядков реакции.
- •Зависимость скорости реакции от температуры
- •Сложные реакции
- •Работа 5.1. Кинетика омыления этилацетата в присутствии ионов гидроксила.
- •Порядок выполнения работы:
- •Определение æ0.
- •Определение константы скорости реакции при разных температурах.
- •Определение энергии активации и предэкспоненциального множителя.
- •Перед выполнением работы:
- •К защите работы:
- •Работа 5.2. Изучение кинетики гомогенно-каталитического разложения н2о2 .
- •Порядок подготовки установки к работе и работа на ней.
- •Порядок проведения кинетических опытов:
- •Варианты задания и методика расчетов.
- •Изучение зависимости скорости реакции разложения перекиси водорода от концентрации катализатора.
- •Влияние начальной концентрации н2о2 на период полупревращения. Определение порядка реакции.
- •III. Определение константы равновесия и константы скорости реакции разложения перекиси водорода.
- •Перед выполнением работы:
- •К защите работы:
- •Работа 5.3. Изучение кинетики инверсии сахарозы.
- •Методика измерения угла вращения на поляриметре (сахариметре)
- •Методика измерения угла вращения на автоматическом поляриметре
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
- •Работа 5.4. Изучение кинетики реакции окисления иодид-ионов ионами трёхвалентного железа фотометрическим методом
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
Варианты задания и методика расчетов.
Изучение зависимости скорости реакции разложения перекиси водорода от концентрации катализатора.
Исходные данные:
концентрация Н2О2 – 0,15 моль/л;
концентрация K2Cr2O7 – 0,02; 0,04; 0,06; 0,08 моль/л;
температура – комнатная.
Порядок проведения опыта:
Подготовить реактор к работе, как описано выше п.п.А. 6-8.
Провести кинетический опыт (см. п.п. В) и получить зависимость количества выделившегося кислорода от времени. Результаты записать в таблицу 5.2.1.
Провести аналогичные измерения для разных исходных концентраций катализатора. Количество перекиси водорода во всех опытах не изменяется. Построить кинетические кривые в координатах .
Рассчитать максимальный объём кислорода (в мл), который может выделиться при полном разложении 15 мл данной концентрации по формуле 5.35.
Рассчитать объем кислорода, который выделяется при разложении половины исходного количества
 .
.Из графиков для каждой кинетической кривой определить время полупревращения
 и величину
и величину
 .
.Рассчитать скорость реакции
 в момент времени
по формуле (5.36). Результаты вычислений
записать в таблицу 5.2.2.
в момент времени
по формуле (5.36). Результаты вычислений
записать в таблицу 5.2.2.
 5.36
5.36
Таблица 5.2.2.
![]() =
……….
=
……….
![]() = …………….
= …………….
№ опыта |
|
|
|
|
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
|
Графическое дифференцирование проводится по схеме, показанной на рисунке 5.7.

Рисунок 5.7 . а - графическое определение скорости реакции разложения Н2О2 , б - зависимость скорости реакции от начальной концентрации катализатора
Построить график зависимости
 .
.
Влияние начальной концентрации н2о2 на период полупревращения. Определение порядка реакции.
Порядок реакции можно определить по
времени полупревращения
![]() перекиси водорода. Скорость разложения
описывается уравнением:
перекиси водорода. Скорость разложения
описывается уравнением:
![]() 5.37
5.37
Интегрируя это выражение, получим:
![]()
При
![]() ,
,
![]() и
и
![]() или
или
![]() 5.38
5.38
Если имеются значения
для различных исходных концентраций
перекиси водорода
,
то в координатах
![]() получают линейную зависимость,
позволяющую определить порядок реакции
n. Тангенс угла наклона данной прямой
равен (1 - n).
получают линейную зависимость,
позволяющую определить порядок реакции
n. Тангенс угла наклона данной прямой
равен (1 - n).
Исходные данные:
концентрация Н2О2 – 0,3 моль/л;
концентрация K2Cr2O7 – 0,02 моль/л;
температура – комнатная.
Порядок проведения опыта:
Подготовить реактор к работе, как описано выше п.п.А. 6-8.
Провести 4 кинетических опыта (см. п.п. В) и получить зависимости количества выделившегося кислорода от времени для растворов с различной концентрацией Н2О2 и одинаковой концентрацией катализатора. Результаты записать в таблицу 5.2.3., в которой указаны составы реакционных смесей.
Расчитать исходные концентрации Н2О2 в реакторе , величины ,
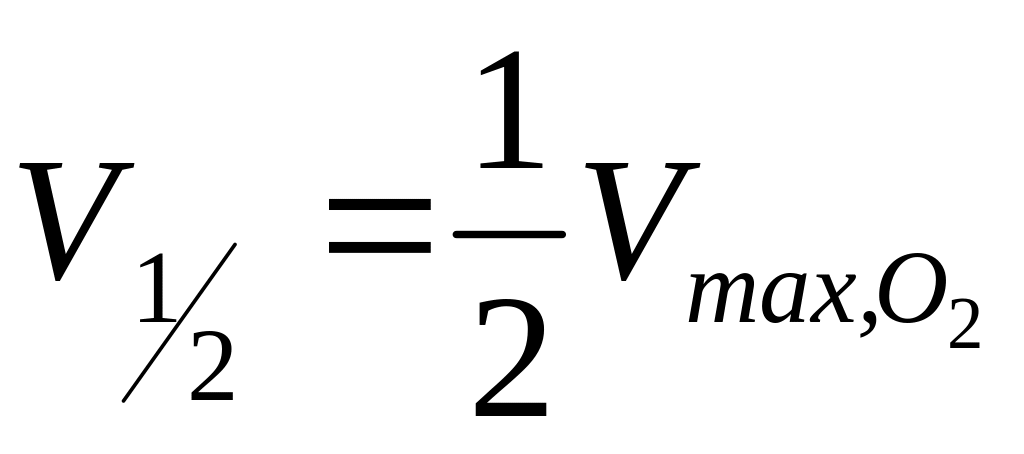 как описано в задании I. Из графика
определить время полупревращения
.
Результаты записать в таблицу 5.2.3.
как описано в задании I. Из графика
определить время полупревращения
.
Результаты записать в таблицу 5.2.3.
Таблица 5.2.3.
№ опыта |
|
|
|
|
|
|
|
n |
Раствор 1 |
Раствор 2 |
|||||||
1 |
4 |
6 |
2 |
|
|
|
|
|
2 |
6 |
4 |
2 |
|
|
|
|
|
3 |
8 |
2 |
2 |
|
|
|
|
|
4 |
10 |
0 |
2 |
|
|
|
|
|
Построить линейную зависимость , определить тангенс угла наклона прямой
 и вычислить величину порядка реакции.
и вычислить величину порядка реакции.
