- •Практикум по общей химии
- •ЧАсть I
- •1. Порядок работы в химической лаборатории
- •Правила безопасности при работе студентов в химической лаборатории
- •Правила пользования газовой горелкой
- •Правила пользования реактивами, посудой, правила нагревания
- •Оказание первой помощи в лаборатории при несчастных случаях
- •2. Основные законы химии
- •3.Основные классы химических соединений
- •Практические работы
- •4. Строение атома и радиоактивность
- •Правила заполнения электронами атомных орбиталей (ао)
- •Практические работы
- •5. Периодический закон и система д.И. Менделеева. Свойства элементов
- •Практические работы Свойства s-элементов
- •Свойства р-элементов
- •Свойства р-элементов четвертой группы
- •Свойства р-элементов пятой группы
- •Свойства р-элементов шестой группы
- •Свойства р-элементов седьмой группы
- •Свойства d-металлов.
- •Свойства d-металлов шестой группы
- •Свойства d-элементы восьмой группы.
- •Свойства d-элементов второй группы.
- •6. Химия координационных соединений
- •Координационная связь. Свойства комплексных соединений
- •Практические работы
- •7. Химическая связь и строение молекул
- •Схемы образования мо
- •Заполнение мо лкао электронами
- •Схемы гибридизации
- •Практические работы
- •1. Изучение строения молекул с помощью комплекта шарико-стержневых моделей атомов и химических связей.
- •2. Химические (кислотно-основные, окислительно-восстановительные) свойства атомов и молекул элемента.
- •8. Основы химической термодинамики
- •Практические работы Тепловой эффект (энтальпия) реакции нейтрализации.
- •9. Кинетика и равновесие химических реакций
- •Практические работы
- •10. Растворы электролитов
- •10.1 Свойства растворов электролитов
- •П Рис. 5. Установка для определения электропроводности растворов: 1 - амперметр; 2 - стакан с электролитом; 3 - графитовые электроды; 4 - пробка; 5 - реостат. Рактические работы
- •10.2 Электролитическая диссоциация и рН раствора
- •Практические работы
- •10.3 Гидролиз солей
- •Практические работы
- •11. Окислительно-восстановительные реакции
- •11.1 Окислительно-восстановительные реакции и потенциалы
- •Практические работы
- •3. Влияние характера среды на протекание окислительно-восстановительной реакции:
- •11.2 Химическая стойкость металлов в водных растворах
- •Практические работы
- •12. Электрохимические процессы
- •12.1 Исследование работы химического источника тока
- •Практические работы
- •12.2 Электролиз и нанесение гальванических покрытий
- •Практические работы
- •12.3 Коррозия металлов и защита от коррозии
- •Практические работы
- •2. Электрохимическая коррозия и защита в растворах электролитов
- •Правила оформления лабораторных работ
- •Литература
- •Приложение
- •Давление водяного пара (h; мм.Рт.Ст.)
- •Стандартные энтальпии образования н0298, энтропии s0298 и энергии Гиббса g0298 некоторых веществ при 298 к (250 с)
- •Константы диссоциации кислот и оснований
- •Множители и приставки для образования десятичных кратных
- •Правила «выживания» в химической лаборатории
- •Издательство «Экоцентр»
Правила заполнения электронами атомных орбиталей (ао)
2 .
Принцип запрета Паули.
На одной АО могут находиться не более
чем два электрона, которые должны иметь
различные спиновые магнитные квантовые
числа ms
(направления спинов должны быть
противоположными).
.
Принцип запрета Паули.
На одной АО могут находиться не более
чем два электрона, которые должны иметь
различные спиновые магнитные квантовые
числа ms
(направления спинов должны быть
противоположными).
![]()
3. Правило Хунда. АО заполняются электронами так, чтобы их суммарный спин был максимальным.
4. Правило Клечковского. При переходе от одного элемента к другому электроны размещаются последовательно на орбиталях, расположенных в порядке возрастания суммы главного и орбитального квантовых чисел (n+l). При одинаковых значениях этой суммы первой заполняется орбиталь с меньшим значением главного квантового числа n.
Электронная конфигурация атома – распределение электронов по атомным орбиталям в соответствии с правилами заполнения.
Все атомы характеризуются индивидуальным набором спектральных линий электромагнитной шкалы.
Энергия ионизации (э.и.) Энергией ионизации называется энергия, которую необходимо затратить для отрыва электрона от атома, часто ее приводят в электронвольтах, тогда ее называют потенциалом ионизации (п.и.).
Сродство к электрону (с.э.) – энергия выделемая при присоединении электрона к атому, характеризует способность атома образовывать отрицательно заряженные ионы.
Электроотрицательность (э.о.) χ – условная величина, характеризующая способность атома в химическом соединении притягивать к себе электроны. Существуют шкалы Полинга и Малликена (см. приложение). Наиболее простой способ расчета электроотрицательности предложил Малликен: χ=э.и.+с.э./2
Важнейшей характеристикой атома является размер, атомный радиус, измеряемый в ангстремах (1А=10–8 см).
Все атомы одного и того же элемента имеют одинаковое число протонов и, следовательно, одинаковый заряд ядра, но могут содержать различное количество нейтронов, а значит, и различное массовое число. Такие атомы называют изотопами. Следовательно, изотопы – это атомы одного и того же химического элемента, отличающиеся друг от друга содержанием нейтронов в ядре. Например, водород имеет такие изотопы: Н – протий (Z=1, А=1), D – дейтерий (Z=1, А=2) и Т – тритий (Z=1, А=3). Почти все химические элементы состоят из нескольких изотопов. Изотопы делятся на две группы: стабильные и радиоактивные. Ядра стабильных изотопов вполне устойчивы, ядра радиоактивных изотопов самопроизвольно распадаются, превращаясь в ядра других элементов.
Радиоактивность – самопроизвольное превращение неустойчивого изотопа одного химического элемента в атомы другого, сопровождающееся радиоактивным излучением. Существуют α-распад (испускание ядер гелия 42Не), β--распад (β - электронный), β+ -распад (b-позитронный) и К-захват. α-распаду подвергаются главным образом ядра тяжелых элементов, например:
![]() (4.2)
(4.2)
Пример β-
- распад:
![]() n→р+β-
(4.3)
n→р+β-
(4.3)
Пример β+
- распад:
![]() р→n+β+
(4.4)
р→n+β+
(4.4)
При том и другом распаде осуществляется взаимное превращение нуклонов в ядре.
Ядра некоторых радиоактивных изотопов могут поглощать один из электронов К-оболочки собственного атома. Порядковый номер ядра уменьшается на единицу при том же массовом числе. Таким образом, превращение при К-захвате аналогично превращению при позитронном распаде, с той разницей, что К-захват не сопровождается испусканием частиц.
Если рассматривать совокупность некоторого числа радиоактивных ядер, то, очевидно, с течением времени это число должно уменьшаться за счет радиоактивного распада. Ясно, что число радиоактивных ядер ∆N распадающихся за промежуток времени ∆t пропорционально величине этого промежутка, общему числу ядер данной совокупности N. Кроме того, оно зависит от свойств ядер данного изотопа, определяемых их внутренней структурой.
Основной закон радиоактивного распада может быть записан математически в следующем виде:
![]() (4.5)
(4.5)
где λ – постоянная распада (зависит от свойств данного изотопа). Знак минус указывает на уменьшение числа радиоактивных ядер с течением времени.
Отношение dN/dt представляет собой скорость радиоактивного распада. Следовательно, основной закон радиоактивного распада имеет следующую формулировку: скорость радиоактивного распада пропорциональна числу радиоактивных ядер. Закон радиоактивного распада может быть представлен в другой, более удобной форме:
![]() (4.6)
(4.6)
где N0 – число радиоактивных ядер в момент времени t=0;
N – число радиоактивных ядер к моменту времени t; е – основание натуральных логарифмов.
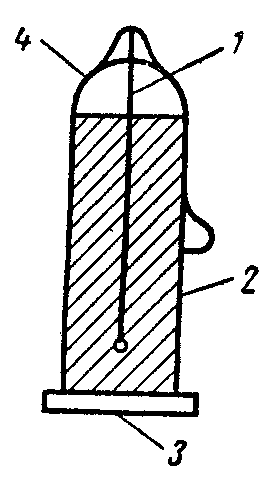
|
Рис. 3. Счетчик для измерения b-лучей: 1 – металлическая нить – анод; 2 – слой меди – катод; 3 – слюдяное окошко для выпуска b–частиц; 4 – стеклянный цилиндр |