
- •Практикум по общей химии
- •ЧАсть I
- •1. Порядок работы в химической лаборатории
- •Правила безопасности при работе студентов в химической лаборатории
- •Правила пользования газовой горелкой
- •Правила пользования реактивами, посудой, правила нагревания
- •Оказание первой помощи в лаборатории при несчастных случаях
- •2. Основные законы химии
- •3.Основные классы химических соединений
- •Практические работы
- •4. Строение атома и радиоактивность
- •Правила заполнения электронами атомных орбиталей (ао)
- •Практические работы
- •5. Периодический закон и система д.И. Менделеева. Свойства элементов
- •Практические работы Свойства s-элементов
- •Свойства р-элементов
- •Свойства р-элементов четвертой группы
- •Свойства р-элементов пятой группы
- •Свойства р-элементов шестой группы
- •Свойства р-элементов седьмой группы
- •Свойства d-металлов.
- •Свойства d-металлов шестой группы
- •Свойства d-элементы восьмой группы.
- •Свойства d-элементов второй группы.
- •6. Химия координационных соединений
- •Координационная связь. Свойства комплексных соединений
- •Практические работы
- •7. Химическая связь и строение молекул
- •Схемы образования мо
- •Заполнение мо лкао электронами
- •Схемы гибридизации
- •Практические работы
- •1. Изучение строения молекул с помощью комплекта шарико-стержневых моделей атомов и химических связей.
- •2. Химические (кислотно-основные, окислительно-восстановительные) свойства атомов и молекул элемента.
- •8. Основы химической термодинамики
- •Практические работы Тепловой эффект (энтальпия) реакции нейтрализации.
- •9. Кинетика и равновесие химических реакций
- •Практические работы
- •10. Растворы электролитов
- •10.1 Свойства растворов электролитов
- •П Рис. 5. Установка для определения электропроводности растворов: 1 - амперметр; 2 - стакан с электролитом; 3 - графитовые электроды; 4 - пробка; 5 - реостат. Рактические работы
- •10.2 Электролитическая диссоциация и рН раствора
- •Практические работы
- •10.3 Гидролиз солей
- •Практические работы
- •11. Окислительно-восстановительные реакции
- •11.1 Окислительно-восстановительные реакции и потенциалы
- •Практические работы
- •3. Влияние характера среды на протекание окислительно-восстановительной реакции:
- •11.2 Химическая стойкость металлов в водных растворах
- •Практические работы
- •12. Электрохимические процессы
- •12.1 Исследование работы химического источника тока
- •Практические работы
- •12.2 Электролиз и нанесение гальванических покрытий
- •Практические работы
- •12.3 Коррозия металлов и защита от коррозии
- •Практические работы
- •2. Электрохимическая коррозия и защита в растворах электролитов
- •Правила оформления лабораторных работ
- •Литература
- •Приложение
- •Давление водяного пара (h; мм.Рт.Ст.)
- •Стандартные энтальпии образования н0298, энтропии s0298 и энергии Гиббса g0298 некоторых веществ при 298 к (250 с)
- •Константы диссоциации кислот и оснований
- •Множители и приставки для образования десятичных кратных
- •Правила «выживания» в химической лаборатории
- •Издательство «Экоцентр»
2. Основные законы химии
Основой химии является атомно-молекулярное учение. Химическому элементу соответствует атом, соединениям – молекула. Молекулы образованы из атомов посредством химических связей.
Молекулярная масса (М) – масса молекулы, выраженная в атомных единицах массы. Молекулярная масса равна сумме атомных масс всех атомов, из которых состоит молекула.
Моль – количество вещества, содержащее столько же структурных единиц (атомов, молекул, ионов или др.), сколько содержится атомов углерода в 0,012 кг (12 г) изотопа углерода-12 (молярная масса в г/моль численно равна молекулярной массе).
Закон сохранения массы (Ломоносов – Лавуазье). Общая масса реагентов равна общей массе продуктов реакции. Для уравнения реакции:
аА + bB = AaBb (2.1)
закон сохранения массы можно записать как
m(A) + m(B) = m(AaBb), или в общем виде: ∑mj =∑mj (2.2)
Закон кратных отношений (Дальтон). Если два элемента образуют друг с другом несколько химических соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как простые целые числа.
Закон постоянства состава (Пруст). Всякое чистое вещество, независимо от способа его получения, всегда имеет постоянный качественный и количественный состав. Соединения, отвечающие этому закону – дальтониды, соединения с переменным составом – бертоллиды, например, – TiO2±х (х=0,2).
Закон эквивалентных отношений (Рихтер). Массы реагирующих веществ относятся между собой как их молярные массы эквивалентов.
![]() (2.3)
(2.3)
где mA, mB – массы реагирующих веществ, ЭА, ЭВ– их химические эквиваленты.
Химическим эквивалентом элемента называется такое его количество, которое соединяется с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Между молекулярной массой М, молярной массой эквивалента Э и валентностью В элемента А существует соотношение
![]() (2.4)
(2.4)
![]() (2.5)
(2.5)
![]() (2.6)
(2.6)
![]() (2.7)
(2.7)
Закон Авогадро. В равных объемах любых газов при одинаковых условиях содержится одинаковое число молекул. Молекулы простых газов двухатомны (Н2, О2, N2).
1 моль – 22,4 л – 6,023∙1023 молекул (NА – число Авогадро) при нормальных условиях (273,15 К, 101,325 кПа).
Уравнение Менделеева – Клапейрона.
![]() (2.8)
(2.8)
где Р – давление газа, Па; V – его объем, м3; m – масса вещества, г;
М – его мольная масса, г/моль; Т – абсолютная температура, К;
R – универсальная газовая постоянная, равная 8,314 Дж/(моль · К).
Закон Дюлонга-Пти.
Произведение атомной массы на удельную теплоемкость есть величина постоянная равная 25Дж/моль∙К.
A∙Cуд=25Дж/моль∙К
Суд – удельная теплоемкость, количество тепла, которое необходимо затратить на нагревание 1 г вещества на один градус.
П
Рис.
2 Прибор для определения эквивалента
металла методом вытеснения водорода
из кислоты:
1-бюретка для измерения водорода; 2-сосуд
Ландольта;
3-каучуковая трубка;
4-воронка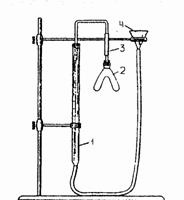
Определение химического эквивалента. В работе используется метод вытеснения водорода из кислот металлами. Эквивалент металла определяется с помощью прибора, изображенного на рис. 2. Через воронку налейте в бюретку (1) воду до нулевого деления. Плотно закройте отверстие бюретки пробкой со стеклянной трубкой. В одну часть сосуда Ландольта (2) поместите навеску металла. Навеска содержит 0,05 г. Другую часть сосуда наполните на 1/3 объема разбавленной соляной кислотой через воронку. Присоедините сосуд (2) к свободному концу трубки (3), единенной с бюреткой. Проверьте герметичность прибора. Для этого опустите (или поднимите) воронку на 10–15 см. Если уровень воды в бюретке не меняется, то прибор герметичен, и можно приступать к опыту. Если уровень меняется, то необходимо закрыть бюретку и сосуд (2) плотнее и снова проверить сосуд на герметичность.
Запишите с точностью до 0,2 мл уровень воды в бюретке до начала опыта V1, соблюдая равенство уровней воды в бюретке и воронке. Приведите в контакт кислоту и металл, осторожно наклоняя сосуд Ландольта. После растворения металла выждите 5–7 минут, чтобы содержимое сосуда охладилось. Затем выньте из прорези кольца воронку и опустите ее, установите равенство уровней воды в бюретке и воронке. При этом внутри прибора создается давление, равное давлению наружного воздуха. Запишите уровень воды в бюретке после опыта.
Результаты запишите в следующем виде:
навеска металла m1, г;
уровень воды в бюретке:
до опыта V1, мл;
после опыта V2, мл;
объем выделившегося водорода VН, мл;
объем водорода при нормальных условиях V0, мл;
температура опыта Т, К;
барометрическое давление Р, мм рт. ст;
давление насыщенного водяного пара h при температуре опыта, мм рт. ст; (приложение, стр. 77)
эквивалент металла (опытная величина);
эквивалент металла (теоретическая величина);
процент ошибки.
Подсчитайте объем вытесненного водорода (VН) по разности уровней воды в бюретке: VН= V2–V1. Приведите этот объем к нормальным условиям (Т=273К, Р=760 мм. рт. ст.)по формуле:
![]() (2.9)
(2.9)
Рассчитайте химический эквивалент металла.
![]() (2.10)
(2.10)
где 11200 мл – эквивалентный объем водорода при нормальных условиях. Сравните химический эквивалент металла, полученный опытным путем с теоретически подсчитанным и вычислите ошибку опыта в процентах:
![]()
