
- •Практикум по общей химии
- •ЧАсть I
- •1. Порядок работы в химической лаборатории
- •Правила безопасности при работе студентов в химической лаборатории
- •Правила пользования газовой горелкой
- •Правила пользования реактивами, посудой, правила нагревания
- •Оказание первой помощи в лаборатории при несчастных случаях
- •2. Основные законы химии
- •3.Основные классы химических соединений
- •Практические работы
- •4. Строение атома и радиоактивность
- •Правила заполнения электронами атомных орбиталей (ао)
- •Практические работы
- •5. Периодический закон и система д.И. Менделеева. Свойства элементов
- •Практические работы Свойства s-элементов
- •Свойства р-элементов
- •Свойства р-элементов четвертой группы
- •Свойства р-элементов пятой группы
- •Свойства р-элементов шестой группы
- •Свойства р-элементов седьмой группы
- •Свойства d-металлов.
- •Свойства d-металлов шестой группы
- •Свойства d-элементы восьмой группы.
- •Свойства d-элементов второй группы.
- •6. Химия координационных соединений
- •Координационная связь. Свойства комплексных соединений
- •Практические работы
- •7. Химическая связь и строение молекул
- •Схемы образования мо
- •Заполнение мо лкао электронами
- •Схемы гибридизации
- •Практические работы
- •1. Изучение строения молекул с помощью комплекта шарико-стержневых моделей атомов и химических связей.
- •2. Химические (кислотно-основные, окислительно-восстановительные) свойства атомов и молекул элемента.
- •8. Основы химической термодинамики
- •Практические работы Тепловой эффект (энтальпия) реакции нейтрализации.
- •9. Кинетика и равновесие химических реакций
- •Практические работы
- •10. Растворы электролитов
- •10.1 Свойства растворов электролитов
- •П Рис. 5. Установка для определения электропроводности растворов: 1 - амперметр; 2 - стакан с электролитом; 3 - графитовые электроды; 4 - пробка; 5 - реостат. Рактические работы
- •10.2 Электролитическая диссоциация и рН раствора
- •Практические работы
- •10.3 Гидролиз солей
- •Практические работы
- •11. Окислительно-восстановительные реакции
- •11.1 Окислительно-восстановительные реакции и потенциалы
- •Практические работы
- •3. Влияние характера среды на протекание окислительно-восстановительной реакции:
- •11.2 Химическая стойкость металлов в водных растворах
- •Практические работы
- •12. Электрохимические процессы
- •12.1 Исследование работы химического источника тока
- •Практические работы
- •12.2 Электролиз и нанесение гальванических покрытий
- •Практические работы
- •12.3 Коррозия металлов и защита от коррозии
- •Практические работы
- •2. Электрохимическая коррозия и защита в растворах электролитов
- •Правила оформления лабораторных работ
- •Литература
- •Приложение
- •Давление водяного пара (h; мм.Рт.Ст.)
- •Стандартные энтальпии образования н0298, энтропии s0298 и энергии Гиббса g0298 некоторых веществ при 298 к (250 с)
- •Константы диссоциации кислот и оснований
- •Множители и приставки для образования десятичных кратных
- •Правила «выживания» в химической лаборатории
- •Издательство «Экоцентр»
Схемы гибридизации
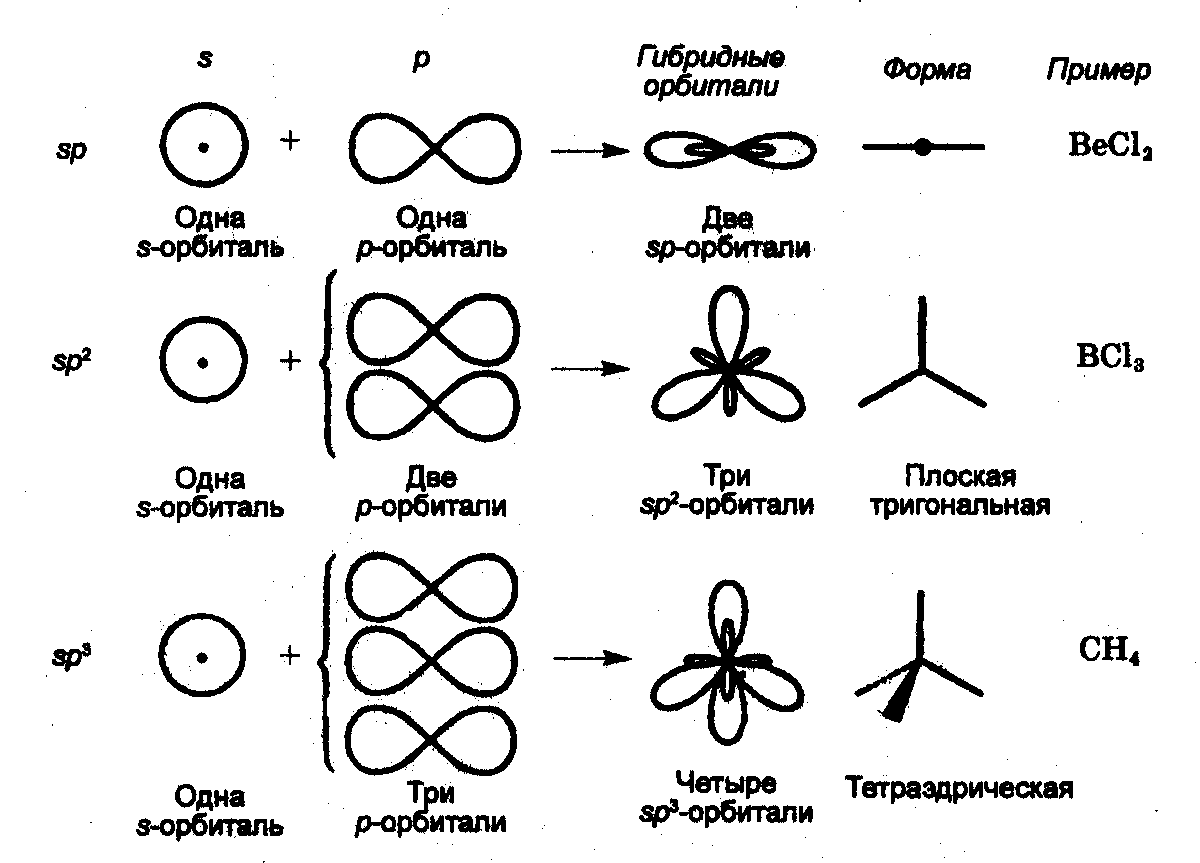
С учетом геометрии имеем:
Тип гибридизации |
Примеры |
Валентные углы |
Формы молекул |
sp sp2 sp3 sp3d sp3 d2 |
BeF2 BF3,CO2-3 CH4 PCI5 SF6 |
180º 120º 109.5º 90º и 120º 90º |
линейная плоский треугольник тетраэдр тригон. бипирамида октаэдр |
Типы химической связи: ковалентная (неполярная, полярная), ионная, металлическая.
Химическая связь, осуществляемая электронными парами, называется ковалентной.
В случае неполярной ковалентной связи молекулярная орбиталь (электронное облако), образованное общей парой электронов, распространяется в пространстве симметрично относительно ядер обоих атомов. Например: Cl2, H2. У них электронная пара в одинаковой мере принадлежит обоим атомам. В случае полярной ковалентной связи электронное облако связи смещено к атому с большей относительной электроотрицательностью. Например: HCl, H2O.
Химическая связь между ионами, осуществляемая электростатическим притяжением, называется ионной связью. Ионная связь реализуется в кристаллах. Они образуются элементами, которые существенно отличаются по электроотрицательности (NaCl, KNO3, CuSO4).
Химическая связь, образующаяся в результате электрического притяжения между ионами металла и обобществленными валентными электронами ("электронным газом") называется металлической связью. Она реализуется в металлах и сплавах.
Практические работы
1. Изучение строения молекул с помощью комплекта шарико-стержневых моделей атомов и химических связей.
Строение молекул на основе метода валентных связей удобно представлять и изучать с помощью различных моделей атомов и химических связей. Например, шарико-стержневых моделей, где атомы представлены в виде шаров различных цветов и размеров, а химические связи – в виде стержней с различными длинами и диаметрами, соединяя которые можно построить молекулы, оценить их геометрические размеры и динамику.
1.1 Ознакомиться с инструкцией к комплекту (набору) шарико-стержневых моделей атомов для сборки молекул.
1.2 Соберите модели простейших двух-, трехатомных молекул (H2, Cl2, HCl, H2O, SO2 и др.)
1.3 Соберите модели четырех-, пятиатомных молекул (NH3, CH4, HNO3, и др.).
1.4 Оцените характер межмолекулярных взаимодействий на примере собранных молекул (пункт 1.3).
Например: NH3 + H2O, NH3 + HCl.
2. Химические (кислотно-основные, окислительно-восстановительные) свойства атомов и молекул элемента.
2.1 Атомарные и молекулярные свойства водорода. Разбавленный раствор серной кислоты подкрасить несколькими каплями перманганата калия и разделить на две одинаковые части. В одну из них бросить кусочек цинка, в другую пропустить водород из аппарата Киппа. Сравнить, с какой скоростью происходит изменение цвета раствора в пробирках. Объяснить разницу в скорости обесцвечивания растворов. Реакция восстановления перманганата калия происходит по уравнению:
2KMnO4+10H+3H2SO4=2MnSO4+K2SO4+8H2O
2.2 Атомарные и молекулярные свойства кислорода. К раствору иодида калия, подкисленного равным объемом серной кислоты, прилейте раствор перекиси водорода. Объясните наблюдаемое. Что будет происходить, если вместо перекиси водорода пропустить ток кислорода?
