
- •Практикум по общей химии
- •ЧАсть I
- •1. Порядок работы в химической лаборатории
- •Правила безопасности при работе студентов в химической лаборатории
- •Правила пользования газовой горелкой
- •Правила пользования реактивами, посудой, правила нагревания
- •Оказание первой помощи в лаборатории при несчастных случаях
- •2. Основные законы химии
- •3.Основные классы химических соединений
- •Практические работы
- •4. Строение атома и радиоактивность
- •Правила заполнения электронами атомных орбиталей (ао)
- •Практические работы
- •5. Периодический закон и система д.И. Менделеева. Свойства элементов
- •Практические работы Свойства s-элементов
- •Свойства р-элементов
- •Свойства р-элементов четвертой группы
- •Свойства р-элементов пятой группы
- •Свойства р-элементов шестой группы
- •Свойства р-элементов седьмой группы
- •Свойства d-металлов.
- •Свойства d-металлов шестой группы
- •Свойства d-элементы восьмой группы.
- •Свойства d-элементов второй группы.
- •6. Химия координационных соединений
- •Координационная связь. Свойства комплексных соединений
- •Практические работы
- •7. Химическая связь и строение молекул
- •Схемы образования мо
- •Заполнение мо лкао электронами
- •Схемы гибридизации
- •Практические работы
- •1. Изучение строения молекул с помощью комплекта шарико-стержневых моделей атомов и химических связей.
- •2. Химические (кислотно-основные, окислительно-восстановительные) свойства атомов и молекул элемента.
- •8. Основы химической термодинамики
- •Практические работы Тепловой эффект (энтальпия) реакции нейтрализации.
- •9. Кинетика и равновесие химических реакций
- •Практические работы
- •10. Растворы электролитов
- •10.1 Свойства растворов электролитов
- •П Рис. 5. Установка для определения электропроводности растворов: 1 - амперметр; 2 - стакан с электролитом; 3 - графитовые электроды; 4 - пробка; 5 - реостат. Рактические работы
- •10.2 Электролитическая диссоциация и рН раствора
- •Практические работы
- •10.3 Гидролиз солей
- •Практические работы
- •11. Окислительно-восстановительные реакции
- •11.1 Окислительно-восстановительные реакции и потенциалы
- •Практические работы
- •3. Влияние характера среды на протекание окислительно-восстановительной реакции:
- •11.2 Химическая стойкость металлов в водных растворах
- •Практические работы
- •12. Электрохимические процессы
- •12.1 Исследование работы химического источника тока
- •Практические работы
- •12.2 Электролиз и нанесение гальванических покрытий
- •Практические работы
- •12.3 Коррозия металлов и защита от коррозии
- •Практические работы
- •2. Электрохимическая коррозия и защита в растворах электролитов
- •Правила оформления лабораторных работ
- •Литература
- •Приложение
- •Давление водяного пара (h; мм.Рт.Ст.)
- •Стандартные энтальпии образования н0298, энтропии s0298 и энергии Гиббса g0298 некоторых веществ при 298 к (250 с)
- •Константы диссоциации кислот и оснований
- •Множители и приставки для образования десятичных кратных
- •Правила «выживания» в химической лаборатории
- •Издательство «Экоцентр»
6. Химия координационных соединений
Координационными (комплексными) соединениями называются сложные по составу соединения, образованные из простых, способных к самостоятельному существованию, объединенных (связанных в комплекс) посредством химических связей – донорно-акцепторных. Иногда их еще называют соединениями в «квадратных скобках». Например, СоСl3 и NH3 образуют [Co(NH3)6]Cl3.
Координационная связь. Свойства комплексных соединений
Химическая связь, образованная без возникновения новых электронных пар, называется координационной или донорно-акцепторной. Этот вид связи можно иллюстрировать схемой образования иона аммония [NH4]+:
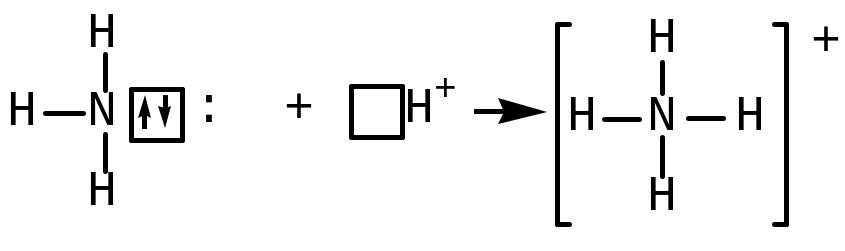
Молекула аммиака возникла за счет образования трех общих электронных пар между атомом азота и тремя атомами водорода. Но у атома азота имеется еще неподеленная пара электронов, а у иона водорода – свободная орбиталь. Ион водорода присоединяется к уже готовой паре, принадлежащей атому азота. Следовательно, химическая связь осуществляется за счет неподеленной пары электронов одного атома и свободной орбитали другого. Атом или ион, предоставляющий неподеленную электронную пару, называется донором, а присоединяющийся к этой электронной паре – акцептором. В ионе аммония [NH4]+ донором является атом азота, а акцептором – ион водорода. Ион, образованный за счет координационной связи, называется комплексным ионом, а соединения, содержащие подобные ионы, – комплексными соединениями.
Строение комплексного соединения можно представить схемой:
Центральное место в комплексных соединениях занимает комплексообразователь. Чаще всего это ионы d-металлов. Непосредственно вокруг комплексообразователя располагаются лиганды, связанные с ним прочной ковалентной координационной связью.
В качестве лигандов могут выступать отрицательные ионы галогенов, кислотные остатки (CNS–, CN–, NO2–), электронейтральные полярные молекулы (Н2О, NH3) и др. Ионы, расположенные далеко от комплексообразователя, связаны с ним менее прочно и составляют внешнюю сферу комплексного соединения. Связь между внутренней и внешней сферой – ионная, поэтому в водных – растворах комплексные соединения диссоциируют, отщепляя ионы внешней сферы.
Заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов. Число лигандов, окружающих комплексообразователь, называется координационным числом (к.ч.). Так, для приведенной на схеме комплексной соли к.ч. равно 6.
Практические работы
1. Получение соли аммония. Стеклянную палочку смочите концентрированной соляной кислотой (тяга!) и поднесите к открытой склянке с концентрированным раствором аммиака. Наблюдайте образование белого дыма. Составьте уравнение реакции.
2. Обнаружение иона аммония NH4+ в реакциях обмена. К 2–3 каплям хлорида аммония прибавьте две капли свежеприготовленного раствора комплексной соли Na3[Co(NO2)6] – гексанитрокобальтата (III) натрия. Наблюдайте образование желтого осадка (NH4)3[Co(NO2)6]. Составьте уравнение реакции. Напишите схему строения внутренней сферы образованного комплексного соединения.
3. Получение аммиакатов (лиганды – молекулы аммиака). На растворы солей меди (II), никеля (II) и кобальта (II) в отдельных пробирках осторожно, по каплям, подействуйте разбавленным раствором аммиака сначала до образования осадков, потом окрашенных аммиакатов меди, никеля и кобальта. Первый раствор сохраните для последующих опытов. Запишите цвета осадков и растворов. Запишите уравнения реакций:
CuSO4+NH3→[Cu(NH3)4]SO4 – сульфат тетра-аммин меди (II);
CoCl2+NH3→ [Co(NH3)6]Cl2 – хлорид гекса-аммин кобальта (II);
NiSO4+NH3→ [Ni(NH3)6]SO4 – сульфат гекса-аммин никеля (II).
4. Сопоставление свойств простой и комплексной солей меди. Возьмите две пробирки. В одну из них прилейте 3–4 капли сульфата меди CuSO4, в другую – часть раствора сульфата тетра-аммин меди [Cu(NH3)4]SO4, полученного в опыте 3. Добавьте к раствору сульфата меди щелочь (KOH или NaOH) до образования осадка. Напишите уравнения реакции. То же проделайте с раствором [Cu(NH3)4]SO4. Почему в этом случае не выпадает осадок?
5. Обнаружение сульфат-иона. К 3–4 каплям сульфата меди добавьте несколько капель хлорида бария BaCl2 до образования осадка. Напишите уравнение реакции. То же проделайте с раствором [Cu(NH3)4]SO4, полученным в опыте 3. Что наблюдается? Напишите уравнение реакции.
Исходя из опытов 4 и 5, сделайте вывод о составе внутренней и внешней сферы сульфата тетра-аммин меди (II).
В заключение составьте таблицу по прилагаемой форме, включив в нее комплексные соединения, изученные вами в опытах.
Таблица 6.1
Номер опыта |
Формула комплексного соединения |
Комплексо-образователь |
Лиганды |
Координации-онное число |
Комплексный ион (состав и заряд) |
|
|
|
|
|
|
Сопоставьте свойства координационных и простых соединений.
6. Получение соединений с комплексным катионом. В пробирке получить небольшое количество гидроксида никеля (II), затем добавить, перемешивая, избыток концентрированного раствора аммиака до полного растворения осадка. Какое основание более сильное: гидроксид никеля (II) или гидроксид комплексного катиона? При написании реакции учесть, что координационное число никеля равно 6.
7. Влияние концентрации лиганда на комплексообразование. К нескольким каплям раствора хлорида кобальта (II) прилить немного концентрированного раствора роданида калия (KCNS) и наблюдать появление синей окраски ионов [Co(NCS)4]2–. Разбавить полученный раствор водой. Что при этом наблюдается?
8. Комплексные соединения в реакциях обмена. Для того, чтобы лучше наблюдать различие в цвете осадков, эти реакции лучше проделать, смешивая по 2–3 капли растворов на фильтровальной бумаге. Подействовать на раствор соли железа (II) раствором гексацианоферрата (III) калия, а на раствор соли железа (III) – раствором гексацианоферрита (II) калия и сравнить цвета турнбулевой сини и берлинской лазури. Написать уравнения реакций в молекулярной и ионной форме.
