
- •Практикум по общей химии
- •ЧАсть I
- •1. Порядок работы в химической лаборатории
- •Правила безопасности при работе студентов в химической лаборатории
- •Правила пользования газовой горелкой
- •Правила пользования реактивами, посудой, правила нагревания
- •Оказание первой помощи в лаборатории при несчастных случаях
- •2. Основные законы химии
- •3.Основные классы химических соединений
- •Практические работы
- •4. Строение атома и радиоактивность
- •Правила заполнения электронами атомных орбиталей (ао)
- •Практические работы
- •5. Периодический закон и система д.И. Менделеева. Свойства элементов
- •Практические работы Свойства s-элементов
- •Свойства р-элементов
- •Свойства р-элементов четвертой группы
- •Свойства р-элементов пятой группы
- •Свойства р-элементов шестой группы
- •Свойства р-элементов седьмой группы
- •Свойства d-металлов.
- •Свойства d-металлов шестой группы
- •Свойства d-элементы восьмой группы.
- •Свойства d-элементов второй группы.
- •6. Химия координационных соединений
- •Координационная связь. Свойства комплексных соединений
- •Практические работы
- •7. Химическая связь и строение молекул
- •Схемы образования мо
- •Заполнение мо лкао электронами
- •Схемы гибридизации
- •Практические работы
- •1. Изучение строения молекул с помощью комплекта шарико-стержневых моделей атомов и химических связей.
- •2. Химические (кислотно-основные, окислительно-восстановительные) свойства атомов и молекул элемента.
- •8. Основы химической термодинамики
- •Практические работы Тепловой эффект (энтальпия) реакции нейтрализации.
- •9. Кинетика и равновесие химических реакций
- •Практические работы
- •10. Растворы электролитов
- •10.1 Свойства растворов электролитов
- •П Рис. 5. Установка для определения электропроводности растворов: 1 - амперметр; 2 - стакан с электролитом; 3 - графитовые электроды; 4 - пробка; 5 - реостат. Рактические работы
- •10.2 Электролитическая диссоциация и рН раствора
- •Практические работы
- •10.3 Гидролиз солей
- •Практические работы
- •11. Окислительно-восстановительные реакции
- •11.1 Окислительно-восстановительные реакции и потенциалы
- •Практические работы
- •3. Влияние характера среды на протекание окислительно-восстановительной реакции:
- •11.2 Химическая стойкость металлов в водных растворах
- •Практические работы
- •12. Электрохимические процессы
- •12.1 Исследование работы химического источника тока
- •Практические работы
- •12.2 Электролиз и нанесение гальванических покрытий
- •Практические работы
- •12.3 Коррозия металлов и защита от коррозии
- •Практические работы
- •2. Электрохимическая коррозия и защита в растворах электролитов
- •Правила оформления лабораторных работ
- •Литература
- •Приложение
- •Давление водяного пара (h; мм.Рт.Ст.)
- •Стандартные энтальпии образования н0298, энтропии s0298 и энергии Гиббса g0298 некоторых веществ при 298 к (250 с)
- •Константы диссоциации кислот и оснований
- •Множители и приставки для образования десятичных кратных
- •Правила «выживания» в химической лаборатории
- •Издательство «Экоцентр»
7. Химическая связь и строение молекул
Теории для объяснения химических связей базируются на кулоновских, квантовых и волновых взаимодействиях электронов, ядер атомов и молекул. Прежде всего, они должны объяснять выигрыш энергии при образовании молекул из атомов, длину химической связи, геометрию и свойства молекул.
Схема образования химической связи
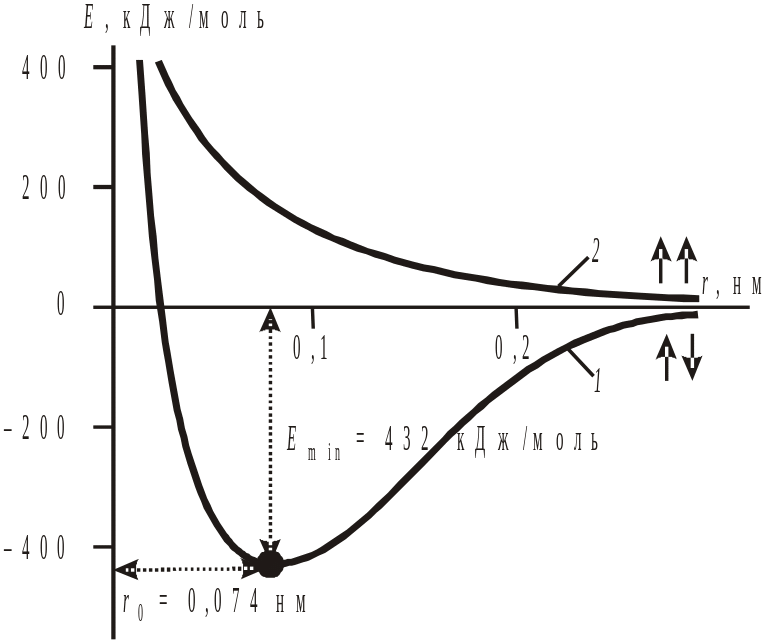
Рис. 4. 1) если сближаются атомы, спины которых спарены
(антипараллельны), химсвязь образуется;
2) если сближаются атомы, спины которых не спарены
(параллельны).
Для квантово-механического описания химической связи и строения молекул применяют два взаимодополняющих метода: метод валентных связей и метод молекулярных орбиталей.
В основе метода валентных связей (ВС) лежат следующие положения:
1. Ковалентная химическая связь образуется двумя электронами, обладающими противоположно направленными спинами и принадлежащими двум атомам молекулы, между которыми осуществляется связь.
Такая общая электронная пара может образоваться как в результате спаривания двух неспаренных электронов, принадлежащих разным атомам (обычный механизм образования ковалентной связи), так и за счет пары электронов одного атома – донора и вакантной орбитали второго атома – акцептора (донорно-акцепторный механизм образования связи).
2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Поэтому ковалентная связь образуется в том направлении, при котором это перекрывание максимально. Ковалентная связь может быть полярной, если атомы отличаются электроотрицательностью, в этом случае электронная плотность химической связи смещена в сторону более электроотрицательного атома.
Метод молекулярных орбиталей исходит из предположения, что состояние электронов в молекуле может быть описано как совокупность атомных электронных орбиталей (линейная комбинация атомных орбиталей – молекулярная орбиталь, ЛКАО-МО), причем двум атомным орбиталям, образующим химическую связь соответствуют две молекулярные орбитали, симметрично различающиеся по энергии относительно исходных атомных. Как и в любой другой многоэлектронной системе, в молекуле также сохраняет свою справедливость принцип Паули, так что на каждой МО может находиться не более двух электронов, которые должны обладать противоположно направленными спинами. Действует также правило Хунда, согласно которому минимальной энергии молекулы соответствует такое распределение электронов по энергетически равноценным орбиталям, при котором абсолютное значение суммарного спина молекулы максимально. Если на МО имеются неспаренные электроны, молекула парамагнитна; если все электроны спарены – диамагнитна.
Молекулярная орбиталь, способствующая выигрышу энергии будет называться связывающей, наоборот – разрыхляющей (*).
Если комбинируются две АО (например, 1s-АО двух атомов водорода), то образуются две МО, отличные по энергии от исходных АО; одна из них соответствует более низкой энергии электронов (связывающая МО), а вторая – более высокой энергии электронов (разрыхляющие МО) по сравнению с их энергией на АО.
В частном случае молекулярная электронная орбиталь может быть сосредоточена вблизи одного из атомных ядер, входящих в состав молекулы такой электрон практически принадлежит одному атому и не принимает участия в образовании связи. Подобные МО называются несвязывающими, по энергии они соответствуют АО изолированных атомов.
Если преобладающая часть электронного облака (орбитали) принадлежит двум или нескольким ядрам, это отвечает образованию двух- или многоцентровых связей соответственно.
В общем случае из n исходных АО образуется n МО. Химическая связь между атомами реализуется в том случае, когда число электронов на связывающих МО превышает число электронов на разрыхляющих МО. Под кратностью (порядком) связи в методе МО понимают полуразность числа связывающих и числа разрыхляющих электронов. Ординарная связь соответствует двум связывающим электронам. Чем выше кратность связи, тем меньше длина связи и больше энергия связи.
С учетом симметрии атомных орбиталей молекулярные орбитали называются сигма (σ) – связями, характеризующимися максимумом электронной плотности вдоль оси химической связи, и пи (π) – связями, для которых максимум перекрывания АО – вне оси химической связи.
