
- •Практикум по общей химии
- •ЧАсть I
- •1. Порядок работы в химической лаборатории
- •Правила безопасности при работе студентов в химической лаборатории
- •Правила пользования газовой горелкой
- •Правила пользования реактивами, посудой, правила нагревания
- •Оказание первой помощи в лаборатории при несчастных случаях
- •2. Основные законы химии
- •3.Основные классы химических соединений
- •Практические работы
- •4. Строение атома и радиоактивность
- •Правила заполнения электронами атомных орбиталей (ао)
- •Практические работы
- •5. Периодический закон и система д.И. Менделеева. Свойства элементов
- •Практические работы Свойства s-элементов
- •Свойства р-элементов
- •Свойства р-элементов четвертой группы
- •Свойства р-элементов пятой группы
- •Свойства р-элементов шестой группы
- •Свойства р-элементов седьмой группы
- •Свойства d-металлов.
- •Свойства d-металлов шестой группы
- •Свойства d-элементы восьмой группы.
- •Свойства d-элементов второй группы.
- •6. Химия координационных соединений
- •Координационная связь. Свойства комплексных соединений
- •Практические работы
- •7. Химическая связь и строение молекул
- •Схемы образования мо
- •Заполнение мо лкао электронами
- •Схемы гибридизации
- •Практические работы
- •1. Изучение строения молекул с помощью комплекта шарико-стержневых моделей атомов и химических связей.
- •2. Химические (кислотно-основные, окислительно-восстановительные) свойства атомов и молекул элемента.
- •8. Основы химической термодинамики
- •Практические работы Тепловой эффект (энтальпия) реакции нейтрализации.
- •9. Кинетика и равновесие химических реакций
- •Практические работы
- •10. Растворы электролитов
- •10.1 Свойства растворов электролитов
- •П Рис. 5. Установка для определения электропроводности растворов: 1 - амперметр; 2 - стакан с электролитом; 3 - графитовые электроды; 4 - пробка; 5 - реостат. Рактические работы
- •10.2 Электролитическая диссоциация и рН раствора
- •Практические работы
- •10.3 Гидролиз солей
- •Практические работы
- •11. Окислительно-восстановительные реакции
- •11.1 Окислительно-восстановительные реакции и потенциалы
- •Практические работы
- •3. Влияние характера среды на протекание окислительно-восстановительной реакции:
- •11.2 Химическая стойкость металлов в водных растворах
- •Практические работы
- •12. Электрохимические процессы
- •12.1 Исследование работы химического источника тока
- •Практические работы
- •12.2 Электролиз и нанесение гальванических покрытий
- •Практические работы
- •12.3 Коррозия металлов и защита от коррозии
- •Практические работы
- •2. Электрохимическая коррозия и защита в растворах электролитов
- •Правила оформления лабораторных работ
- •Литература
- •Приложение
- •Давление водяного пара (h; мм.Рт.Ст.)
- •Стандартные энтальпии образования н0298, энтропии s0298 и энергии Гиббса g0298 некоторых веществ при 298 к (250 с)
- •Константы диссоциации кислот и оснований
- •Множители и приставки для образования десятичных кратных
- •Правила «выживания» в химической лаборатории
- •Издательство «Экоцентр»
Практические работы
1. Влияние концентрации на скорость реакции тиосульфата натрия с серной кислотой. В три пробирки налейте 0,1 н. раствор тиосульфата натрия: в первую – 5 мл, во вторую – 10 мл и третью – 15 мл. После этого в первую пробирку добавьте 10 мл, а во вторую – 5 мл дистиллированной воды. Затем в три другие пробирки налейте по 5 мл 0,1 н. раствора серной кислоты. Слейте попарно приготовленные растворы, в результате чего произойдет реакция
Na2S2O3+H2SO4=Na2SO4+SO2+H2O+S
С помощью секундомера отметьте, через какое время появляется сера в каждой пробирке. Результаты запишите в следующую таблицу:
Таблица 9.1
Номер |
Объем, мл |
|
|||
опыта |
Na2S2O3 |
H2SO4 |
воды |
общий |
Время, с |
1 |
5 |
5 |
10 |
|
|
2 |
10 |
5 |
5 |
|
|
3 |
15 |
5 |
|
|
|
Какой вывод можно сделать из полученных данных?
2. Зависимость скорости реакции от температуры. Влияние температуры на скорость реакции взаимодействия тиосульфата натрия с серной кислотой. Приготовьте шесть одинаковых стаканов. В три стакана налейте по 15 мл 0,1 н. раствора тиосульфата натрия, а в другие три стакана – по 15 мл 0,1 н. раствора серной кислоты. Нагрейте на водяной бане одну пару стаканов с растворами тиосульфата натрия и серной кислоты до температуры на 10°С выше, а другую пару стаканов на 20°С выше комнатной в течение 15–20 мин, контролируя температуру воды термометром. Пока растворы нагреваются, слейте оставшиеся растворы тиосульфата натрия и серной кислоты при комнатной температуре. Отметьте время появления серы в стаканах. То же проделайте и с подогретыми растворами. Полученные данные запишите в таблицу:
Таблица 9.2
Номер опыта |
Объем, мл |
Температура |
Время, с |
|
Na2S2O3 |
H2SO4 |
|||
|
|
|
|
|
Какие выводы можно сделать относительно влияния температуры на скорость реакции из полученных результатов?
3. Изучение скорости реакции разложения перекиси водорода. Перекись водорода самопроизвольно медленно разлагается в соответствии с уравнением: Н2О2=Н2О+1/2О2. Скорость этого процесса можно увеличить введением катализатора и оценивать количеством выделенного кислорода за определенный промежуток времени. Опыт проводится в приборе, изображенном на рис. 2. Налейте через воронку в бюретку воды приблизительно до нулевого деления, плотно закройте отверстие бюретки пробкой со стеклянной трубкой. В одно колено сосуда Ландольта налейте с помощью воронки 1 мл раствора хлорида железа III – катализатор. В другое колено с помощью воронки налейте перекись водорода заданной преподавателем концентрации. Затем соедините сосуд Ландольта с бюреткой при помощи пробки с газоотводной трубкой. Проверьте герметичность прибора. Поместите сосуд Ландольта в термостат с заданной температурой и выдержите 10–15 мин. Установите одинаковый уровень воды в уравнительной воронке и бюретке, запишите величину уровня. Наклоняя сосуд Ландольта, приведите перекись водорода в контакт с катализатором. Через каждые 1–2 мин в течении 30 мин измеряйте объем выделенного кислорода Vτ. Результаты измерений запишите в табл. 9.3.
Таблица 9.3
Номер измерения |
Время от начала реакции τ, мин |
Объем выделившегося газа Vτ, мл |
Максимальный объем газа V∞, мл |
V∞-Vτ |
lg(V∞-Vτ) |
Константа скорости κ |
|
|
|
|
|
|
|
После полного разложения перекиси водорода сосуд Ландольта охладите до начальной температуры термостата, и вновь измерьте объем полностью выделенного кислорода V∞. По данным табл. 9.3 и по формуле
![]() (9.17)
(9.17)
произведите расчет константы скорости реакции. Построить график зависимости:
![]() (9.18)
(9.18)
Определите по тангенсу угла наклона прямой к оси абсцисс константу скорости реакции и сравните со среднеарифметическим значением (9.17). Целесообразно проводить опыты при двух температурах: 15–25°С и 30–40°С.
По значениям константы скорости реакции для двух температур по формуле:
![]()
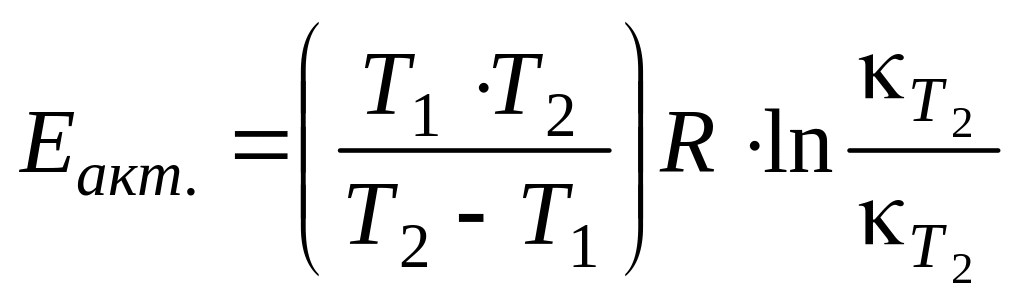 ,
(9.19)
,
(9.19)
где R=8,314 Дж/моль∙К, рассчитайте энергию активации реакции разложения перекиси водорода.
4. Влияние концентрации реагентов на химическое равновесие. При взаимодействии раствора хлорида железа (III) с роданидом калия образуются растворимые вещества и изменяется окраска растворов. Реакция обратимая:
FeCl3+3KCNS Fe(CNS)3+3KCl
Записать в таблице цвета растворов всех веществ системы:
Таблица 9.4.
Раствор→ |
FeCl3 |
KSCN |
Fe(CNS)3 |
KCl |
Окраска→ |
|
|
|
|
Смешать в пробирке по 5 мл растворов хлорида железа (III) и роданида калия. Отметить окраску полученного раствора. Указать вещество, сообщившее окраску системе. Разлить полученный раствор в четыре пробирки по возможности равными частями. В первую пробирку добавить немного концентрированного раствора хлорного железа, во вторую – раствора роданида калия, в третью – немного кристаллического хлорида калия. Четвертую пробирку оставить для сравнения. Сравнить окраску растворов в пробирках и укажите, в каком направлении сместилось равновесие при добавлении FeCl3, KSCN и KCl. Составить уравнение для константы равновесия изученной реакции.
5. Влияние изменения температуры на химическое равновесие. При действии иода на крахмал образуется непрочное соединение сложного состава, окрашенное в синий цвет. Равновесие системы можно условно изобразить следующим уравнением:
Крахмал + иод иодокрахмальный комплекс
Налить в пробирку 2-3 мл раствора крахмала и добавить несколько капель иодной воды до появления синей окраски раствора. Нагреть пробирку до посветления раствора, а затем охладить до возвращения синей окраски. Определить какая реакция (прямая или обратная) является экзотермической, какая эндотермической. Объяснить изменение цвета при нагревании и охлаждении.
