- •Практикум по общей химии
- •ЧАсть I
- •1. Порядок работы в химической лаборатории
- •Правила безопасности при работе студентов в химической лаборатории
- •Правила пользования газовой горелкой
- •Правила пользования реактивами, посудой, правила нагревания
- •Оказание первой помощи в лаборатории при несчастных случаях
- •2. Основные законы химии
- •3.Основные классы химических соединений
- •Практические работы
- •4. Строение атома и радиоактивность
- •Правила заполнения электронами атомных орбиталей (ао)
- •Практические работы
- •5. Периодический закон и система д.И. Менделеева. Свойства элементов
- •Практические работы Свойства s-элементов
- •Свойства р-элементов
- •Свойства р-элементов четвертой группы
- •Свойства р-элементов пятой группы
- •Свойства р-элементов шестой группы
- •Свойства р-элементов седьмой группы
- •Свойства d-металлов.
- •Свойства d-металлов шестой группы
- •Свойства d-элементы восьмой группы.
- •Свойства d-элементов второй группы.
- •6. Химия координационных соединений
- •Координационная связь. Свойства комплексных соединений
- •Практические работы
- •7. Химическая связь и строение молекул
- •Схемы образования мо
- •Заполнение мо лкао электронами
- •Схемы гибридизации
- •Практические работы
- •1. Изучение строения молекул с помощью комплекта шарико-стержневых моделей атомов и химических связей.
- •2. Химические (кислотно-основные, окислительно-восстановительные) свойства атомов и молекул элемента.
- •8. Основы химической термодинамики
- •Практические работы Тепловой эффект (энтальпия) реакции нейтрализации.
- •9. Кинетика и равновесие химических реакций
- •Практические работы
- •10. Растворы электролитов
- •10.1 Свойства растворов электролитов
- •П Рис. 5. Установка для определения электропроводности растворов: 1 - амперметр; 2 - стакан с электролитом; 3 - графитовые электроды; 4 - пробка; 5 - реостат. Рактические работы
- •10.2 Электролитическая диссоциация и рН раствора
- •Практические работы
- •10.3 Гидролиз солей
- •Практические работы
- •11. Окислительно-восстановительные реакции
- •11.1 Окислительно-восстановительные реакции и потенциалы
- •Практические работы
- •3. Влияние характера среды на протекание окислительно-восстановительной реакции:
- •11.2 Химическая стойкость металлов в водных растворах
- •Практические работы
- •12. Электрохимические процессы
- •12.1 Исследование работы химического источника тока
- •Практические работы
- •12.2 Электролиз и нанесение гальванических покрытий
- •Практические работы
- •12.3 Коррозия металлов и защита от коррозии
- •Практические работы
- •2. Электрохимическая коррозия и защита в растворах электролитов
- •Правила оформления лабораторных работ
- •Литература
- •Приложение
- •Давление водяного пара (h; мм.Рт.Ст.)
- •Стандартные энтальпии образования н0298, энтропии s0298 и энергии Гиббса g0298 некоторых веществ при 298 к (250 с)
- •Константы диссоциации кислот и оснований
- •Множители и приставки для образования десятичных кратных
- •Правила «выживания» в химической лаборатории
- •Издательство «Экоцентр»
11.2 Химическая стойкость металлов в водных растворах
Металл, растворяющийся в воде, растворе кислоты или основания, является восстановителем (Red), он окисляется. Это растворение может быть целенаправленным (химическое фрезерование) и нежелательным (коррозия). Необходимым условием протекания окислительного - восстановительного (Ох-Red) процесса является наличие окислителя (Ох).
В кислотной среде (0≤рН<7) в качестве окислителя могут выступать ионы водорода Н+ или «сложный» окислитель Н++О2; в нейтральной (рН=7) и в щелочной среде (7<рН≤14) окислителем являются молекулы Н2О или смесь воды и кислорода (Н2О+ О2).
Металл,
контактирующий одновременно с газом и
раствором, содержащим ионы этого газа,
называется газовым электродом (водородным,
кислородным и др.). Потенциалы водородного
(уравнения 11.22 и 11.23) и кислородного
(уравнения 11.24 и 11.25) электродов не зависят
от формы разряжающихся частиц (молекул
воды или ионов, на которые она диссоциирует),
но зависят от рН среды и парциального
давления водорода
![]() и кислорода
и кислорода
![]() .
.
2Н++2![]() =Н2 (11.22) 2H2O+2
=2ОН–+Н2 (11.23)
=Н2 (11.22) 2H2O+2
=2ОН–+Н2 (11.23)
4Н++О2+4 =2H2O (11.24) 2H2O+О2+4 =4ОН– (11.25)
Зависимость
![]() и
и
![]() от рН при
от рН при
![]() =
=![]() =1ат
представлена уравнениями (11.26, 11.27) и
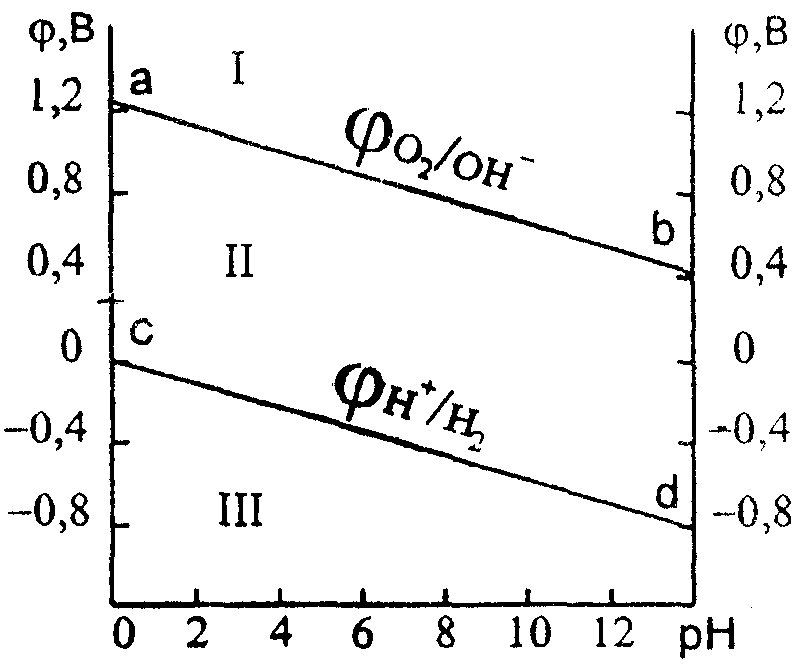
графически – в виде диаграммы
электрохимической устойчивости воды
(рис. 6).
=1ат
представлена уравнениями (11.26, 11.27) и
графически – в виде диаграммы
электрохимической устойчивости воды
(рис. 6).
![]() (11.26)
(11.26)
![]() (11.27)
(11.27)
По диаграмме (рис. 6) можно установить химическую стойкость металлов в растворах с различным значением рН.
Если стандартный
потенциал металла (![]() )
положительнее
(область 1, выше линии ab),
то растворение металла с процессами
восстановления по уравнениям (11.22–11.25)
невозможно. Все точки в области 1
соответствуют состоянию когда молекулы
воды (или ионы гидроксила) могут выступать
лишь как восстановители. Такое состояние
имеет место на аноде при электролизе
водных растворов или при взаимодействии
воды или основания с сильным окислителем
(уравнения 11.28 и 11.29).
)
положительнее
(область 1, выше линии ab),
то растворение металла с процессами
восстановления по уравнениям (11.22–11.25)
невозможно. Все точки в области 1
соответствуют состоянию когда молекулы
воды (или ионы гидроксила) могут выступать
лишь как восстановители. Такое состояние
имеет место на аноде при электролизе
водных растворов или при взаимодействии
воды или основания с сильным окислителем
(уравнения 11.28 и 11.29).
2Cl2+2H2O=4HCl+O2 (11.28)
2Cl2+4NaOH=4NaCl+2H2O+O2 (11.29)
В химических реакциях (11.28) и (11.29) молекулы воды и ионы гидроксила выступают как восстановители. В табл. 8 приложения все металлы и ионы (уравнения 11.24 и 11.25) указаны как окислители. Для использования уравнений (11.24) и (11.25) в реакциях (11.28) и (11.29) необходимо электроны из левой части уравнения перенести в правую с обратным знаком. Если положительнее и отрицательнее |
Рис. 6. Диаграмма электрохимической устойчивости воды. |
(все точки между линиями ab и cd, область II), то растворение металла возможно, когда окислителем является (H++O2) или (H2O+O2), а не ионы водорода или молекулы воды (опыт 4). Все точки в области II соответствуют электрохимической устойчивости воды. В этой области в химических реакциях и при электролизе вода не может выступать ни окислителем, ни восстановителем.
Все точки ниже линии cd (область III) отвечают состоянию системы, когда молекулы H2O или Н+ в реакциях с металлами выступают как окислители. Этот случай условно называется «коррозией с водородной деполяризацией», которая происходит при взаимодействии H2O или ион Н+ с активными металлами (опыты 1, 2, 3). В области III при наличии в растворе газообразного кислорода в качестве окислителя в реакции с металлами могут также выступать сложные окислители (H2O+O2) или (H++O2). Этот случай условно называется «коррозией с кислородной деполяризацией». Таким образом, в области III могут выступать четыре окислителя, т.е. имеется возможность протекания четырех реакций восстановления (уравнения 11.22–11.25).
В общем случае, при наличии в растворе нескольких видов ионов или недиссоциированных молекул электрохимически активных веществ последовательность протекания реакций восстановления определяется величиной их стандартного потенциала. В первую очередь, окислителем выступают те ионы, молекулы или их сочетания, которые характеризуются наиболее положительным потенциалом. Это, в частности, имеет место при растворении металлов в кислородсодержащих кислотах (HNO3, H2SO4 и др.), когда в качестве окислителя могут выступать анионы кислотного остатка.
Учитывая сказанное, легко объяснить почему при взаимодействии металлов с азотной кислотой не выделятся газообразный водород (опыт 6–8).