- •Практикум по общей химии
- •ЧАсть I
- •1. Порядок работы в химической лаборатории
- •Правила безопасности при работе студентов в химической лаборатории
- •Правила пользования газовой горелкой
- •Правила пользования реактивами, посудой, правила нагревания
- •Оказание первой помощи в лаборатории при несчастных случаях
- •2. Основные законы химии
- •3.Основные классы химических соединений
- •Практические работы
- •4. Строение атома и радиоактивность
- •Правила заполнения электронами атомных орбиталей (ао)
- •Практические работы
- •5. Периодический закон и система д.И. Менделеева. Свойства элементов
- •Практические работы Свойства s-элементов
- •Свойства р-элементов
- •Свойства р-элементов четвертой группы
- •Свойства р-элементов пятой группы
- •Свойства р-элементов шестой группы
- •Свойства р-элементов седьмой группы
- •Свойства d-металлов.
- •Свойства d-металлов шестой группы
- •Свойства d-элементы восьмой группы.
- •Свойства d-элементов второй группы.
- •6. Химия координационных соединений
- •Координационная связь. Свойства комплексных соединений
- •Практические работы
- •7. Химическая связь и строение молекул
- •Схемы образования мо
- •Заполнение мо лкао электронами
- •Схемы гибридизации
- •Практические работы
- •1. Изучение строения молекул с помощью комплекта шарико-стержневых моделей атомов и химических связей.
- •2. Химические (кислотно-основные, окислительно-восстановительные) свойства атомов и молекул элемента.
- •8. Основы химической термодинамики
- •Практические работы Тепловой эффект (энтальпия) реакции нейтрализации.
- •9. Кинетика и равновесие химических реакций
- •Практические работы
- •10. Растворы электролитов
- •10.1 Свойства растворов электролитов
- •П Рис. 5. Установка для определения электропроводности растворов: 1 - амперметр; 2 - стакан с электролитом; 3 - графитовые электроды; 4 - пробка; 5 - реостат. Рактические работы
- •10.2 Электролитическая диссоциация и рН раствора
- •Практические работы
- •10.3 Гидролиз солей
- •Практические работы
- •11. Окислительно-восстановительные реакции
- •11.1 Окислительно-восстановительные реакции и потенциалы
- •Практические работы
- •3. Влияние характера среды на протекание окислительно-восстановительной реакции:
- •11.2 Химическая стойкость металлов в водных растворах
- •Практические работы
- •12. Электрохимические процессы
- •12.1 Исследование работы химического источника тока
- •Практические работы
- •12.2 Электролиз и нанесение гальванических покрытий
- •Практические работы
- •12.3 Коррозия металлов и защита от коррозии
- •Практические работы
- •2. Электрохимическая коррозия и защита в растворах электролитов
- •Правила оформления лабораторных работ
- •Литература
- •Приложение
- •Давление водяного пара (h; мм.Рт.Ст.)
- •Стандартные энтальпии образования н0298, энтропии s0298 и энергии Гиббса g0298 некоторых веществ при 298 к (250 с)
- •Константы диссоциации кислот и оснований
- •Множители и приставки для образования десятичных кратных
- •Правила «выживания» в химической лаборатории
- •Издательство «Экоцентр»
12.1 Исследование работы химического источника тока
Химические источники тока (ХИТ) представляют собой устройства, в которых химическая энергия окислительно-восстановительной реакции непосредственно превращается в электрическую. Условием работы ХИТ является разделение единого окислительно-восстановительного процесса на процесс окисления и процесс восстановления. Оба процесса протекают на различных пространственно разделенных металлах, называемых электродами. Процессы окисления протекают на аноде, восстановления – на катоде.
Электродвижущая сила гальванического элемента равна разности потенциалов катода φк и анода φа при отсутствии тока в цепи:
∆Е=φк–φа (12.4)
В процессе работы ХИТ потенциалы электродов изменяются вследствие поляризации электродов. Изменение потенциалов приводит к уменьшению эдс и препятствует нормальной работе гальванического элемента, поэтому на практике ее устраняют. Процесс уменьшения поляризации электродов называют деполяризацией, а вещества или ионы, применяемые для этой цели – деполяризаторами.
Практические работы
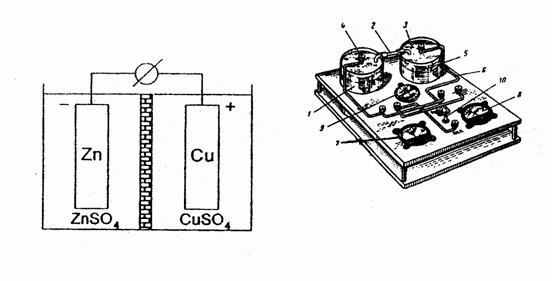
1. Работа гальванического элемента Якоби - Даниэля. Соберите гальванический элемент согласно схеме: Zn|ZnSO4||CuSO4|Cu, как на рис. 7,8. В качестве электролитов возьмите 1М раствор сульфата цинка и 1М раствор сульфата меди.
1. Зарисуйте схему работающего гальванического элемента и укажите на ней стрелками направление движения электронов и ионов.
2. Подсчитайте теоретическую величину ЭДС гальванического процесса. Сделайте вывод, является ли исследуемый элемент практически поляризующимся?
3. Закрепите в крышках стаканов с помощью универсальных клемм цинковую и медную пластинки и погрузите их в раствор.
4. Соберите схему подключением клемм электродов к вольтметру. Измерьте ЭДС, сравните с теоретическим значением. Наблюдается ли при этом выделение водорода, изменяется ли во времени ЭДС?
Рис. 7. Схема элемента Якоби-Даниэля.
|
Рис. 8. Установка для определения ЭДС гальванического элемента: 1–батарейные стаканы; 2–стеклянные трубки; 3–изолирующие крышки; 4–универсальные клеммы; 5 – электроды; 6–провода; 7–вольтметр; 8–гальванометр; 9–секундомер; 10–выключатель. |
5. Привести установку в исходное состояние после окончания эксперимента. В лабораторный журнал запишите: а) схему гальванического элемента; б) уравнение процессов на аноде и катоде; в) суммарное уравнение окислительно-восстановительной реакции.
2. Рассмотрите, дайте анализ работы гальванических элементов согласно схемам:
Cu|CuSO4||CuSO4|Cu; Zn|ZnSO4||ZnSO4|Zn; Zn|Н2SO4|Cu,
0,001М 2М 0,001М 0,1М
варьируя концентрацию кислоты, сделайте соответствующие выводы.
3. Работа сухого элемента, в котором в качестве электролита используется гелеобразная паста, например, MnO2, NH4Cl и H2O, в которую помещают угольный стержень (катод), роль анода выполняет цинковая оболочка элемента.
На аноде: Zn(тв) – 2е = Zn2+(водн.), φ = – 0,76 В
На катоде:
2MnO2(тв)+2NH4+(водн)+2е = Mn2O3(тв)+2NH3(водн)+H2O(ж), φ=+0,84В
Zn(тв)+2MnO2(тв)+2NH4+(водн.)=Zn2+(водн)+Mn2O3(тв)+2NH3(водн)+H2O(ж),
∆Е = φк. – φа. = 1,6 В
С учетом реакций гидратации, гидролиза, электролитической диссоциации, диспропорционирования:
Mn2O3+3H2O→2Mn(ОН)3, 2Mn3+ Mn4++Mn2+
О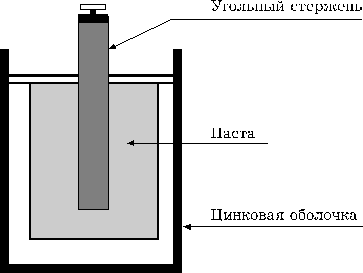 бъясните
возможность продления срока эксплуатации
батарейки.
бъясните
возможность продления срока эксплуатации
батарейки.
Сухие элементы являются необратимыми, их называют элементами одноразового действия. Сухие элементы используются в фотовспышках, электрических фонарях, радиоприемниках и. т.д.
Паста: водный гель хлорида аммония и двуокиси марганца. Проанализируйте устройство, работу батарейки.
Рис. 9. Схема сухого элемента.
4. Работа стандартного свинцово-кислотного аккумулятора. Свинцовый аккумулятор состоит из двух перфорированных (с многочисленными отверстиями) свинцовых пластин, одна из которых после зарядки содержит наполнитель пор – губчатый активный свинец, а другая – «зацементированный» диоксид свинца. Обе пластины погружены в 25–30% раствор H2SO4 (Плотность 1,25 – 1,29 г/см3). При разрядке аккумулятора идут процессы:
На аноде:
Pb(тв) + SO42-(водн.) – 2е = PbSO4(тв), φ=–0,36В
На катоде:
PbO2(тв)+4Н+(водн)+SO42-(водн)+2е = PbSO4(тв)+2H2O(ж), φ=+1,68В
Pb(тв) + PbO2(тв) + 2H2SO4(водн.) 2PbSO4(тв) + 2H2O(ж), ∆Е=2,04 В
Наличие образования труднорастворимой соли на электродах и реакции диспропорционирования:
Pb0 + Pb4+ 2 Pb2+
являются необходимым условием работы гальванического элемента как аккумулятора. Если к аккумулятору приложить внешнее напряжение, превышающее его собственное напряжение, то протекающие на электродах реакции могут пойти в обратном направлении, и можно запасти в элементе электрическую энергию. При этом процесс зарядки (электролиз) сопровождается выделением газов. Каких?
Проанализируйте устройство и работу (разряд, заряд) аккумулятора на модельной установке, состоящей из двух свинцовых пластин в растворе серной кислоты.
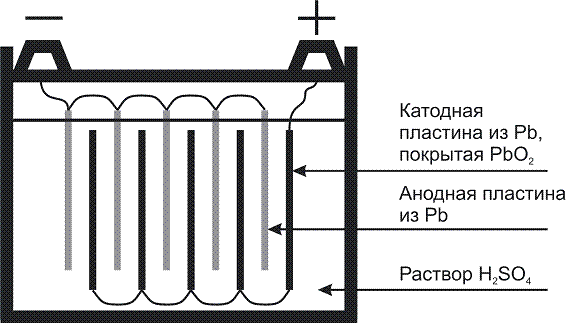
Рис. 10. Схема свинцового аккумулятора.