
Навч.посібник Акушерство, гінекологія та штучне осіменіння с.г. тварин, Харута, 2013
.pdf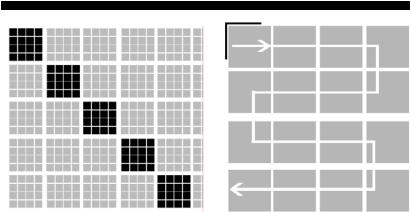
а |
б |
Рис. 8. Схема підрахунку сперміїв у лічильній камері
зсіткою Горяєва:
а– камера з сіткою Горяєва; б – схема підрахунку сперміїв
увеликому квадраті
Концентрацію сперміїв вираховують за формулою:
C = hЧd Ч4000 Ч1000 ,
80
де С – концентрація сперміїв (млрд) у 1 мл сперми;
h – кількість сперміїв, підрахованих у 80 малих квадратах; d – ступінь розрідження.
Числа у формулі є постійними величинами: 4000 – це число переведення на кубічний міліметр (мм3); 1000 – число переведення на мл; 80 – кількість малих квадратів.
Нині для визначення концентрації сперміїв використо вують портативні фотометрии, принцип яких полягає в аналізі проникності сперми світловими променями.
Визначення процента живих і мертвих сперміїв. Для такої оцінки використовують 5 % ий розчин еозину, який забарвлює лише мертві спермії та спермії з коливальним рухом. Для забарвлення мертвих сперміїв у спермі жеребця застосовують
81

фарбу конго рот (на 100 мл 7 % ого розчину глюкози – 1 г фарби).
Досліджують сперму з концентрацією |
сперміїв 0,2– |
0,4 млрд/мл, за більшої концентрації еякулят |
розріджують |
3 % им розчином цитрату натрію. |
|
Для визначення проценту живих і мертвих сперміїв на край знежиреного предметного скла піпеткою або скляною паличкою наносять невелику краплю сперми та 2–3 краплі розчину еозину, який готують на 3 % ому розчині цитрату натрію. Краплі швидко перемішують і з суміші роблять тонкий мазок на предметному склі, який швидко підсушують. Дослідження проводять під мікроскопом за збільшення в 600– 900 разів. У декількох полях зору підраховують 500 сперміїв. Окремо ведуть облік тих, що були на час забарвлення живими і мертвими. Живими вважають тих, що не мають забарвленої цитоплазми головки, а мертвими – із забарвленою. Процент мертвих сперміїв визначають за формулою:
П = М Ч100 ,
500
де П – процент мертвих сперміїв; М – кількість підрахованих мертвих сперміїв;
100 – стала для переведення в проценти;
500 – кількість сперміїв, які підрахували.
Визначення вмісту патологічних форм сперміїв. Спермії кожного виду тварин мають свою характерну форму і розміри. Наявність в еякуляті значної кількості клітин патологічних форм (гігантських і карликових розмірів, з деформованими головками і хвостами, із двома головками і хвостами тощо) знижує заплідненість самок. Тому на племпідприємствах необхідно періодично (один–два рази на рік) визначати вміст сперміїв з патологічними формами і при збільшенні їх кількості проводити андрологічне дослідження самця плідника для виявлення причин цієї патології.
82

Сперму барана розбавляють 0,9 % розчином натрію хлориду у 20–30 разів, бугая – у 10–15, сперму жеребця і кнура – у 2–3 рази. На предметне скло наносять краплю сперми і роблять тонкий мазок, який висушують, фіксують 96% им спиртом впродовж 1–2 хв і забарвлюють 1–2 % розчином фуксину, еозину або метиленового синього. Для цього на мазок кладуть смужку фільтрувального паперу і наливають на неї барвник – на 3–5 хв. Потім мазок змивають дистильованою водою і висушують.
Мікроскопію мазка проводять при збільшенні в 600–1350 разів і підраховують у кількох полях зору не менше 200 нормальних і патологічних сперміїв. Нормальні і патологічні форми сперміїв підраховують окремо.
Процент вмісту сперміїв із патологічною формою визначають за формулою:
Х = |
n Ч1 0 0 |
, |
|
2 0 0 |
|
де n – кількість патологічних форм сперміїв.
Для осіменіння дозволяють використовувати сперму барана, якщо в ній міститься не більше 14 % патологічних форм, сперму бугая – не більше 18 %, кнура – не більше 20 % і жеребця – не більше 25 %.
На світовому ринку представлені автоматичні аналізатори якості сперми, які дають можливість автоматичного визначення концентрації сперміїв, кількості сперміїв з ППР, кількості патологічних форм сперміїв, швидкість та форми руху сперміїв.
Визначення інтенсивності дихання сперміїв базується на використанні сперміями кисню метиленового синього, який додають у сперму, внаслідок чого відбувається знебарвлення розчину. Метиленовий синій є вираженим акцептором водню. Під час приєднання двох іонів водню цей барвник втрачає свій темно синій колір і перетворюється в лейкометиленовий синій білого кольору. Реакція повинна проходити без доступу кисню,
83

оскільки останній швидко окиснює лейкометиленовий синій у метиленовий.
За методикою М.П. Шергіна, на чисте сухе предметне скло підігріте до +30–37 °С, очною піпеткою наносять краплю середнього об’єму отриманої сперми бугая або барана і додають до неї таку ж краплю 0,01 % розчину метиленового синього, підігрітого до +30 °С. Скляною трубочкою із внутрішнім діаметром 0,8–1 мм швидко змішують обидві краплі і набирають у неї суміш так, щоб утворився стовпчик довжиною 2 см без міхурців повітря. Трубку кладуть на білий папір за температури +20–22 °С і спостерігають, через який час стовпчик суміші блакитного кольору знебарвиться. На кінцях трубки, де сперма контактує з повітрям, знебарвлення не проходить. Отримані результати звіряють із даними таблиці і визначають якість сперми (табл. 4).
|
|
Таблиця 4 |
Оцінка якості сперми за часом знебарвлення |
||
метиленового синього (хв) |
|
|
|
|
|
Якість сперми |
Бугай |
Баран |
Добра |
5–10 |
3–7 |
Середня |
11–30 |
8–12 |
Низька (не дозволяється для осіменіння) |
більше 30 |
більше 12 |
Визначення виживаності сперміїв. Для визначення цього показника використовують метод абсолютної виживаності та експрес метод.
Для визначення виживаності сперміїв бугая експрес методом
сперму розморожують у біотермостаті за температури +38±0,5 °С. Фіксують час розморожування й одночасно визна чають початкову рухливість сперміїв. Через п’ять годин оцінку повторюють. Якщо рухливість сперми становитиме 0,5 бала (5 % сперміїв рухатимуться прямолінійно поступально) і більше, то така сперма придатна для використання.
84

Для визначення виживаності сперміїв кнурів сперму інкубують у термостаті за температури +17 – 18 °С та визначають рухливість сперміїв через кожні 24 год. Допускається до використання сперма з рухливістю не менше 6 балів.
За терморезистентною пробою (прискорений метод визна чення виживання сперміїв) сперму кнурів витримують у термостаті за температури +38 °С впродовж 3 год. Показник рухливості сперміїв через цей проміжок часу має становити не менше 6 и балів.
Сперма бугая і барана доброї якості при розрідженні її у 16–32 рази повинна мати абсолютний показник виживання сперміїв не нижче 1400, кнура – не нижче 900, жеребця – не нижче 400.
2.13. РОЗРІДЖЕННЯ СПЕРМИ
Сперму розріджують для збільшення об’єму, кількості спермодоз та осіменіння більшої кількості самок, а також, щоб підтримати запліднювальну здатність сперміїв впродовж усього строку зберігання.
Середовища, які застосовуються для розрідження сперми кнурів, повинні забезпечувати відповідну виживаність сперміїв за межами організму.
Під час використання нерозрідженої сперми одним еякулятом можна штучно осіменити 20–25 корів (по 0,2–0,5 мл на самку), 10–15 овець (об’єм дози – 0,05–0,1 мл), 3–4 кобили (по 20–25 мл), 3–5 свиноматки. Після розрідження еякуляту бугая можна осіменити до 500 корів і телиць; еякуляту барана – 20–30 вівцематок; еякуляту кнура – 8–12 свиноматок; еякуляту жеребця – 10–15 кобил.
Розріджену сперму, залежно від типу синтетичного середовища і методу зберігання, можна використовувати від кількох днів до десятків років.
85

Середовище для розрідження сперми плідників повинно бути ізотонічним – осмотичний тиск сперми і середовища повинен бути однаковим.
Плазма сперми, яка складається переважно із секрету придаткових залоз, полегшує еякуляцію, активує спермії, сприяє їх переміщенню в статевих шляхах самки. Однак під час зберігання сперміїв поза організмом активація завдає шкоди через невиправдані витрати енергетичних ресурсів сперміями. Крім того, під час зберігання в спермі бугая і барана накопи чується молочна кислота, яка згубно діє на статеві клітини.
2.14. СЕРЕДОВИЩА ДЛЯ РОЗРІДЖЕННЯ СПЕРМИ ПЛІДНИКІВ РІЗНИХ ВИДІВ
Середовище для розрідження сперми має відповідати таким вимогам:
•збільшувати об’єм еякуляту (дистильована, бідистильо вана або спеціально підготована вода);
•гальмувати обмінні процеси в сперміях з метою подов ження строку їх зберігання (застосування двооксиду вуглецю, органічних кислот, хелатону);
•забезпечувати спермії речовинами для метаболічних процесів (цукриноелектроліти, глюкоза, лактоза, глікокол, гліцин, мед);
•створювати оптимальні умови для виживаності сперміїв (буферні розчини і мінеральні речовини, лимоннокислий натрій, солі з багатовалентними аніонами, фосфатний буфер, трис буфер, N трисметил 2 аміноетан сульфанілова кислота;
•підвищувати стійкість сперміїв до швидкого охолоджен ня або заморожування (жовток курячого яйця, який містить 7 % лецитину, ліпопротеїди, гліцерин);
•попереджувати розвиток мікроорганізмів (стрептоцид білий розчинний, пеніцилін, стрептоміцин або комплексний препарат “Спермосан 3”);
86

• підвищувати заплідненість самок (гіалуронідаза, проста гландин F2α, рилізинг гормон, ЛГ).
Середовища для розрідження сперми повинні мати певні фізико хімічні властивості і таку концентрацію компонентів, за якої підтримуються необхідний осмотичний тиск і певний рівень кислотності. Підвищена кислотність або лужність призводять до загибелі статевих клітин, тому до складу синтетичного середовища можуть входити лише слабкі кислоти і незначна кількість лугів. Середовища також не повинні містити солей багатовалентних металів (свинцю, олова), а також різних отруйних і ароматичних речовин, які згубно діють на спермії.
Рецепт глюкозо цитратно жовткового середовища подано у табл. 5.
Таблиця 5
Склад глюкозо цитратно жовткового середовища для розбавлення сперми самців сільськогосподарських тварин
Компонент розріджувача |
|
Для сперми |
|
||
барана |
бугая |
кнура |
|
жеребця |
|
Вода дистильована, мл |
100 |
100 |
500 |
|
100 |
Глюкоза медична, г |
0,8 |
3 |
5,0 |
|
7 |
Натріюцитраттризаміщений, г |
2,8 |
1,4 |
0,5 |
|
– |
Жовток курячого яйця, мл |
20 |
10–12 |
30–40 |
|
0,8 |
Стрептоцид білий, г |
0,2 |
0,12 |
0,2 |
|
0,12 |
Пеніцилін, тис.од. |
50–75 |
75–100 |
500 |
|
200 |
Стрептоміцин, тис.од. |
50–75 |
75–100 |
500 |
|
25 |
Окрім вказаного середовища, широко застосовують інші розріджувачі, склад яких залежить від умов зберігання сперми та виду самця (табл. 6).
87

Таблиця 6
Середовища для короткотривалого зберігання сперми
|
|
|
Сперма |
|
|
|
Компонент середовища |
бугая |
барана |
жереб |
кнура |
||
|
|
|
|
ця |
|
|
Скорочена назва син |
|
|
|
|
|
|
тетичного середовища |
ГЦЖ |
ГЦЖ |
ГФЖ |
ЛХЦЖ |
ГХЦ |
ГХЦС |
Вода дистильована, мл |
100 |
100 |
100 |
100 |
1000 |
1000 |
Глюкоза, г |
3 |
0,8 |
3,2 |
– |
60 |
40 |
Лактоза, г |
|
|
|
11 |
|
|
Натрію цитрат тризамі |
|
|
|
|
|
|
щений, г |
1,4 |
2,8 |
|
0,089 |
3,56 |
3,8 |
Гідрокарбонат |
|
|
|
|
|
|
натрію, г |
|
|
|
0,008 |
1,2 |
0,5 |
Натрій фосфатнокислий: |
|
|
|
|
|
|
|
|
|
|
|
|
|
12 водний, г |
|
2,08 |
|
|
|
|
безводний, г |
|
0,82 |
|
|
|
|
Калій фосфатнокислий |
|
|
|
|
|
|
однозаміще |
|
|
|
|
|
|
ний безводний, г |
|
|
|
|
|
|
Сульфат амонію, г |
|
|
|
|
|
1,8 |
Трилон Б, г |
|
|
|
0,1 |
3,7 |
2,6 |
Жовток курячого |
|
|
|
|
|
|
яйця, мл |
20 |
15–20 |
15–20 |
1,6 |
|
|
Спермосан 3, тис. од |
75 –90 |
25 |
25 |
25–30 |
250–300 |
250–300 |
Температура зберігання |
|
|
|
|
|
|
розбавленої сперми, °С |
2–4 |
2–4 |
2–4 |
2–4 |
16–20 |
16–20 |
|
||||||
Максимальний термін |
|
|
|
|
|
|
зберігання, год |
72 |
24 |
24 |
48 |
72 |
72 |
Окрім вищезазначених, на ринку представлені комерційні синтетичні середовища без вмісту тваринних білків. Антимік робні речовини в них представлені лінкоміцином, спектино міцином, гентаміцином та тирозином (табл. 7).
88

|
|
|
Таблиця 7 |
Сучасні середовища для розрідження сперми |
|||
самців сільськогосподарських тварин |
|||
|
|
|
|
Середовища для розрідження сперми |
|||
бугая |
барана |
кнура |
жеребця |
Andromed, |
OviPro |
BTS, BTS 2A, BTS TOP, |
Andromed E |
Andromed CSS, |
Andromed |
Gold, Premium, |
EguiPro |
Triladyl, Biladyl, |
Triladyl |
Stardiluent, |
INRA |
PremixOxyfree, |
Biladyl |
SafeCellPlus, Medium, |
Egcellsire |
Bioxcell, Bioxcell |
|
PRIMXcell, SUS, Gold |
EgcelIfreeze |
CSS Spectall |
|
Life, BIOSOLWENS |
|
|
|
PLUS, Androhip, |
|
|
|
Androstar MaxiGen, |
|
|
|
Magapor, |
|
2.15.САНІТАРНО ГІГІЄНІЧНІ ПРАВИЛА, МЕТОДИКА
ІТЕХНІКА ВИГОТОВЛЕННЯ РОЗРІДЖУВАЧІВ ТА РОЗРІДЖЕННЯ СПЕРМИ
За розрідження сперми необхідно дотримуватись таких санітарно гігієнічних правил:
•використовувати чистий стерильний посуд;
•готувати синтетичне середовище перед розрідженням не більш ніж за 3 години до його використання, а сперму розріджувати впродовж 10 хв після отримання еякуляту (якщо не вдається провести розрідження сперми за 3 години з часу приготування середовища, його не використовують, а готують інше);
•посудини зі спермою та приготовані середовища необхідно закривати кришками або марлевими серветками;
•температура середовища повинна відповідати темпера турі сперми, яку розріджують (низька, порівняно зі спермою,
89

температура розріджувача викликає холодовий удар, а висока – викликає загибель сперміїв);
•допускається відхилення в температурі сперми і середовища ± 1 ºС;
•для синтетичного середовища слід використовувати лише дистильовану, бідистильовану або спеціально підготовану воду;
•середовище необхідно доливати порціями, тонкою цівкою до сперми та ретельно змішувати коливальними рухами (якщо доливати сперму до розріджувача, то спермії потрапляють в умови великого розрідження внаслідок чого можуть загинути);
•усі компоненти середовища мають бути хімічно чистими та точно відважені.
Для приготування розріджувача в стерильну хімічну колбу наливають необхідну кількість дистильованої (бідистильованої) води і добавляють точне наважування компонентів послідовно, відповідно до рецепту, окрім жовтка, антибіотиків і гліцерину. Розмішують середовище похитуванням посуду до повного розчинення стрептоциду. Потім середовище кип’ятять 5–7 хви лин у водяній бані і після охолодження до 30–35 °С вносять у нього жовток курячого яйця, антибіотики і гліцерин.
Курячі яйця перед отриманням жовтка ретельно миють водою за допомогою щітки, протирають тампоном змоченим 96° им спиртом ректифікатом, шкаралупу розколюють стерильним інструментом надвоє, зливають білок у банку, а жовток в оболонці обережно переносять на стерильний аркуш фільтрувального паперу. Щоб звільнити жовтковий мішок від залишків білка, його перекочують на папері. Потім стерильним скальпелем проколюють оболонку жовтка і зливають його в стерильну мензурку, а плівка залишається на папері.
Посудину з приготовленим розріджувачем закривають кришкою і поміщають на водяну баню за температури 30–35 °С
90
