
Навч.посібник Акушерство, гінекологія та штучне осіменіння с.г. тварин, Харута, 2013
.pdf
•складати заявки на придбання сперми, інструментів і обладнання;
•щомісячно подавати звіт згідно із встановленою формою;
•застосовувати заходи підвищення заплідненості корів і
телиць;
•постійно підвищувати кваліфікацію.
На пункті штучного осіменіння дотримуються розпорядку дня з урахуванням пори року і конкретних умов господарства.
Технік штучного осіменіння тварин призначається і звільнюється з посади рішенням керівника господарства за погодженням з племпідприємством.
2.26. ОБЛІК І ЗВІТНІСТЬ У ПУНКТАХ (ЛАБОРАТОРІЯХ) ШТУЧНОГО ОСІМЕНІННЯ
На пункті штучного осіменіння корів і телиць технік веде облік осіменінь і отелень у журналі штучного осіменіння за встановленою формою (3 мол). У ордері, отриманому з племпідприємства під час завезення сперми, зазначає клички і дати осіменіння тварин, якість сперми. Крім того, технік штучного осіменіння оформляє індивідуальні картки на кожну корову за формою 12, де реєструє дату отелення, осіменіння, результати осіменіння (дод. А).
Щомісячно представляє звіт про штучне осіменіння тварин за встановленою формою ЦСУ (дод. Б), а також веде облік отриманого приплоду і кожного місяця подає звіт у бухгалтерію господарства та племпідприємство. Технік штучного осіменіння організовує і бере участь у дослідженні тварин на вагітність та оформленні актів.
Для своєчасного виявлення охоти у корів і телиць та їх осіменіння ведеться спеціальний календар техніка штучного осіменіння (дод. В).
Календар техніка та стенд обліку відтворення корів (дод. Г) дозволяють повніше орієнтуватися у фізіологічному стані стада.
131

Для обліку осіменіння, заплідненості і отелення корів на кожній фермі слід обладнати стенд фізіологічного стану корів. За ведення стенду відповідає зоотехнік та технік штучного осіменіння. На стенді вказують прізвище, ім’я та по батькові доярок і номери корів по групах. Після отелення корови проти її номера вішають жетон синього кольору, після осіменіння – зеленого, прийшла в охоту більше двох разів – жовтого, не прийшла в охоту протягом місяця після отелення і після ректального дослідження виявлена неплідною – червоного. Номери тільних корів залишають без жетонів. Також можна оформити календар вагітності корів у вигляді круглого стенда.
На пункті штучного осіменіння обладнують “Куточок техніка”, де інформують про план та фактичне осіменіння корів і телиць, план та фактичне отелення за місяцями календарного року й вихід телят (дод. Ґ і Д).
Для реєстрації отелень і осіменінь корів, що знаходяться у приватній власності, технік веде окремий журнал (дод. Е).
На пункті штучного осіменіння свиней технік веде облік осіменінь і опоросів. У ордері, отриманому з племпідприємства під час завезення сперми, зазначає клички і дати осіменіння тварин, якість сперми (дод. Є).
2.27. ТРАНСПЛАНТАЦІЯ ЕМБРІОНІВ
Трансплантація ембріонів − біотехнологічний метод відтворення високопродуктивних тварин, шляхом інтенсивного використання генетичного потенціалу самок.
Значення трансплантації ембріонів. Під транспланта цією ембріонів розуміють вилучення ембріонів із статевих органів однієї самки і пересадку їх у статеві органи іншої самки. Вона проводиться у більшості лабораторних тварин, приматів і сільськогосподарських тварин. Найпоширеніший цей метод у скотарстві.
132

Трансплантація ембріонів ефективна лише під час вико ристання генетично цінних високопродуктивних тварин, які перевірені за якістю нащадків і визнані поліпшувачами. Використовуючи 20 корів рекордисток в якості донорів для отримання від них ембріонів, протягом 2−3 років можна створити високопродуктивне молочне стадо в 200−300 корів. Традиційним способом від такої кількості тварин за 2−3 роки можна отримати не більш ніж 30 телиць і 30 бичків.
Таким чином, перевагою трансплантації ембріонів є можливість прискорити селекційний процес за рахунок одержання від племінних самок в 20 разів більше потомства, ніж за фізіологічної репродукції. Саме тому є можливість досить швидко формувати ремонтні групи самок з видатними показниками, поліпшувати адаптацію народжених від реципієнтів у різних географічних зонах, зберегти генофонд локальних, вимираючих і аборигенних видів тварин.
Трансплантація ембріонів − єдиний метод отримання потомства від цінних у племінному відношенні самок, які не можуть виношувати плід внаслідок патології матки.
Під час пересаджування ембріонів не існує тканинної несумісності, що зумовлено імунологічною толерантністю порожнин яйцепроводів і матки як донорів, так і реципієнтів. Окрім цього, до початку імплантації (нідації) ембріонів (безпосереднього контакту прохоріона ембріона та слизової оболонки матки) проходить тривалий час (7−16 днів залежно від виду тварин), протягом якого відбувається пристосування ембріона до нового, материнського організму.
В основі технологічних вирішень трансплантації лежать загальнобіологічні відомості щодо нервово гуморальної регуляції статевої функції, запліднення, внутрішньоутробного розвитку зиготи та ембріона, а також фолікулогенезу.
Технологія трансплантації ембріонів. Трансплантацію ембріонів проводять хірургічним або нехірургічним методами.
133

Хірургічний метод характеризується тим, що у донора вимивають ембріони з рогів мати після лапаротомії. Цей метод одержання ембріонів у донора закінчується хірургічним введенням ембріонів реципієнту.
Нехірургічний метод полягає в тому, що ембріони у донорів вимиваються з рогів матки спеціальними інструмен тами, які вводяться в статеві шляхи самки через трохи відкриту шийку матки. Вводяться ембріони таким же чином, ближче до верхівок рогів матки.
Хірургічний метод трансплантації ембріонів може вико ристовуватися на лабораторних і сільськогосподарських твари нах, а нехірургічний − лише у великих тварин, де є можливість мануально, трансректально контролювати положення інстру ментів у статевих органах самок.
Незалежно від методу трансплантації ембріонів, техно логія включає:
•відбір донорів і реципієнтів;
•синхронізацію статевої охоти у донорів і реципієнтів;
•провокування суперовуляції у донорів;
•осіменіння донорів;
•вимивання ембріонів;
•пошук та оцінка ембріонів;
•пересадку і зберігання ембріонів;
•лізис жовтого тіла у донорів;
•контроль результатів трансплантації.
Донорами вважають тих самок, у яких отримують ембріони. Відбір тварин у донорську групу проводять за комплексом спеціальних ознак (стандарт породи, родовід, продуктивність) і повноцінність статевої функції.
Реципієнтами вважають тих самок, яким пересаджують або підсаджують ембріони. Їх відбирають із фізіологічно зрілих тварин. Доцільно підбирати реципієнтів серед малопродук тивних, аборигенних самок. Чим більша різниця в продук
134

тивності донора і реципієнта, тим більший економічний ефект трансплантації.
Донорів і реципієнтів відбирають у благополучних за інфекційними та інвазійними хворобами господарствах після діагностичних досліджень і карантину.
Синхронізація статевої охоти у донорів і реципієнтів −
приведення організму цих тварин до однакового нервово гуморального стану відносно статевого циклу. Вона буває природною і штучною.
Природною синхронізація буває в тому випадку, коли статева охота і осіменіння у донора збігається із спонтанною охотою у реципієнта. Штучна синхронізація досягається введенням препаратів простагландину F2α (естрофан, прозольвін, клатрапростин, суперфан та ін.), які здатні викликати лізис жовтого тіла яєчників, що зумовлює ріст, розвиток, дозрівання везикулярних фолікулів, прояв феноменів стадії збудження статевого циклу або ж − коїтальним провокуванням овуляції у кролиць і кішок.
Синхронізованим статевий цикл вважається тоді, коли у донора і реципієнта співпадає день прояву статевої охоти. Допускається відхилення не більше як ±1 доба. Кращі результати отримують за абсолютного збігання в часі прояву охоти у донора і реципієнта.
Спрямований вплив на фізіологічну періодичність функції яєчників за допомогою гонадотропних гормонів дозволяє стимулювати ово і фолікулогенез − прискорювати дозрівання ооцитів до яйцеклітин і викликати численну овуляцію фолікулів (суперовуляцію).
Осіменіння донорів проводиться штучно або природно. Під час штучного осіменіння дозу сперми збільшують у кілька разів. Осіменяють донорів до припинення статевої охоти.
Вимивання ембріонів проводять як хірургічним, так і нехірургічним методами. Під час використання хірургічного методу у тварин реєструються післяопераційні ускладнення −
135

спайки, що не дає можливості використовувати донорів більше трьох разів. Тому в практиці трансплантації частіше застосовують нехірургічний метод вимивання ембріонів. Головною перевагою нехірургічного отримання ембріонів є відсутність ризику порушення відтворної здатності у тварин.
Пошук ембріонів проводиться візуально за допомогою бінокулярної лупи за 15−20 кратного збільшення. Після нехірургічного вимивання промивальну рідину збирають в ембріоприймачі − скляні циліндри або флакони, які витримують у термостаті 20 хвилин за +37°С. Протягом цього часу ембріони осідають на дно. Потім верхню частину рідини відкачують за допомогою стерильного сифона та шприца з довгою голкою, залишаючи 60−100 мл. Залишок переносять у чашки Петрі, дно яких розкреслене на рівні квадрати 1 × 1 см. Пошук проводять у квадратах, накреслених на дні чашки Петрі.
Якщо в промивальній рідині багато слизу, то її розбавляють середовищем для вимивання ембріонів і досліджують слиз, маніпулюючи голкою; за великої кількості крові додають середовище і центрифугують протягом 3−5 хвилин за 3−5 тис. обертів/хв. У цьому випадку осад гомогені зується. Після дослідження рідини на наявність ембріонів чашки Петрі кілька разів коливають, щоб виявити ембріони, які прилипли до стінок.
Виявлені ембріони піпеткою Пастера переносять на годинникові скельця з поживним середовищем для тимчасового зберігання (середовище + 20 % фетальної сироватки крові теляти або сироватки крові вівці чи оленя) і зберігають в термостаті при +37° С у чашках Петрі, дно яких вкрите зволоженим фільтру вальним папером. За хірургічного методу трансплантації промивальну рідину зразу ж збирають у чашки Петрі.
Якість ембріонів визначають методами: візуальної морфо логічної оцінки, фарбуванням з використанням люмінесцентних фарбників, культивуванням за межами організму протягом
24 − 48 год.
136

Морфологічну якість ембріонів визначають під мікро скопом при 100−160 кратному збільшенні. Встановлюють стадії їхнього розвитку (ранні та пізні морули і бластоцисти), а також оцінюють якість (відмінну, добру, задовільну). Розрізняють умовно придатні та непридатні до трансплантації ембріони. У промивальній рідині можуть виявитися і яйцеклітини, що свідчить про відсутність запліднення.
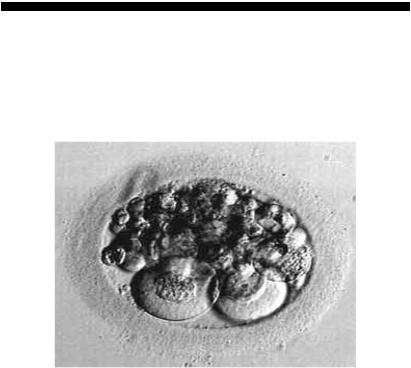
Морула − це специфічне скупчення бластомерів, які не завжди однакові за розмірами через асинхронність дроблення. Цитоплазма бластоцитів гомогенна, вони мають полігональний зв’язок. Перивітелліновий простір морули вільний від гранул і включень, а товщина прозорої оболонки має 15 мк (рис. 14).
Рис. 14. Морула відмінної якості
У ранньої бластоцисти добре видно бластопорожнину, реєструється диференціювання клітин на трофобластичні та ембріобластичні. Перивітелліновий простір вузький, а прозора оболонка має товщину 15 мк.
Пізня бластоциста відрізняється від ранньої тим, що вона має суцільні клітини трофобласта і велику порожнину, яка
137
займає майже всю площу перивітелінового простору. Прозора оболонка витончена і розтягнута.
Ембріони з частковою дегенерацією характеризуються несиметричним розміщенням і різними розмірами бластомерів. У бластомерів може виявитися частковий розпад, порушення зв’язку, несиметричність або відсутність поділу (рис. 15).
Рис. 15. Дегенерований амбріон, непридатний до використання
У бластоцист часто реєструється збільшення об’єму перивітеллінового простору, стискання бластопорожнини, частковий розпад клітин трофобласта і ембріобласта. Прозора оболонка має невеликі тріщини. Такі ембріони умовно придатні до трансплантації.
Дегенеровані ембріони на 3−4 ділення дроблення від стають від нормального розвитку. Вони характеризуються розпадом бластомерів, зміщенням і фрагментацією цито плазми, яка виявляється у перивітелліновому просторі. Прозора оболонка має значні дефекти: тріщини, розшарування, розриви. Такі ембріони вибраковують.
138

Незапліднені яйцеклітини мають форму сфери, прозорий перевітеліновий простір; гомогенне розміщення цитоплазма тичних тілець.
Оцінка ембріонів з використанням люмінесцентних фарбників ґрунтується на різному ступені проникнення фарбників через прозору оболонку живих і мертвих ембріонів.
Оцінка ембріонів методом культивування у поживних середовищах базується на здатності повноцінних ембріонів в оптимальних умовах продовжувати розвиток. Вона також дозволяє зберегти їхню життєздатність до пересаджування протягом 24−48 годин і дає можливість додатково визначати непридатність ембріонів до трансплантації.
Розроблено метод довготривалого зберігання ембріонів із застосуванням глибокого заморожування у рідкому азоті (кріоконсервування) за температури –196 °С. Перевагою цього методу є:
•тривале зберігання ембріонів;
•можливість їхнього транспортування;
•використання ембріонів за наявності реципієнта.
Для заморожування беруть лише свіжоотримані ембріони відмінної та доброї якості.
Пересадка і підсадка ембріонів відрізняються тим, що в першому випадку одержані ембріони вводять синхронізованому реципієнту, який не осіменявся одночасно з донором. Якщо ж реципієнта осіменяли водночас з донором, то йому ембріони підсаджують. Незалежно від методу трансплантації (хірургіч ного або нехірургічного) пересадка або підсадка ембріонів проводиться ближче до верхівок рогів матки.
Лізис (розсмоктування, інволюція) жовтих тіл у донорів проводять внутрішньом’язовим введенням препаратів проста гландину − F2α.
Контроль результатів трансплантації ембріонів проводять за вагітністю реципієнтів.
139

Трансплантація ембріонів у великої рогатої худоби. Під час відбору донорів перевага надається середньовіковим коровам (після третіх родів) з ритмічними та повноцінними статевими циклами. У донорів не повинні реєструватися патології вагітності, родів, післяродового періоду та низька заплідненість. Остаточний відбір проводять після встановлення реакції тварин на введення гонадотропних гормонів з метою викликання суперовуляції. У донорську групу корів переводять лише тоді, коли після першої гормональної обробки вимили не менше чотирьох повноцінних ембріонів і утворилось не менше п’яти жовтих тіл.
За технологією на кожного донора готують 3−5 реци пієнтів − фізіологічно зрілих телиць віком 16−18 міс. з масою
350−380 кг.
Під час синхронізації у “0” й день циклу − день спонтанної повноцінної охоти з метою покращання якості та збільшення кількості ембріонів донорам вводять вітаміни А і Є, а також проводять санацію матки. Застосування вітамінів підвищує чутливість організму корів донорів до гонадотропних препа ратів. Санацію матки проводять для зниження активності мікрофлори, що профілактує ембріональну смертність і підвищує якість ембріонів.
Для санації матки у її порожнину вводять такі препарати: 5 мл біосану (бактеріальний препарат вагінальної палички Дезерлейна); 4–5 мл розчину спермосану 3 або спермосан ППК – 500 – 600 тис. од. (антибіотики розчиняють у 4–5 мл 2,9 % ого розчину цитрату натрію при +38 °С); пеніцилін (700 тис. од), стрептоміцин (200–300 тис. од), стрептоцид або норсульфазол натрію 0,3–0,5 г (суміш розчиняють у 10–30 мл стерильного розчину 1 % го розчину кухонної солі); йодоксид (попередньо розчиняють дистильованою водою в 4 рази) в дозі 10–15 мл, люголівський розчин в дозі 100 – 150 мл та ін.
Для викликання суперовуляції у корів донорів застосо вують гонадотропні препарати: ГСЖК, ФСГ, ФСГ супер, граво
140
