
- •Тема 1.1. Основні закони хімії
- •Закон збереження маси речовини
- •Контрольні запитання:
- •Тема 1.2. Оксиди
- •Визначення. Класифікація оксидів.
- •Контрольні запитання:
- •Тема 1.3. Основи
- •Визначення. Класифікація основ.
- •Контрольні запитання:
- •Тема 1.4. Кислоти
- •Визначення. Класифікація кислот.
- •Контрольні запитання:
- •Тема 1.5. Солі
- •Визначення. Класифікація солей.
- •Контрольні запитання:
- •Тема 1.6. Хімічний зв'язок
- •Поняття про хімічний зв'язок. Типи хімічного зв’язку.
- •Контрольні запитання:
- •Тема 1.7. Електролітична дисоціація. Реакції йонного обміну
- •Контрольні запитання:
- •Тема 1.8. Окисно-відновні реакції
- •Контрольні запитання:
- •Тема 2.1. Загальна характеристика металів
- •Контрольні запитання:
- •Тема 2.2. Корозія металів
- •Корозія металів. Види корозії.
- •Контрольні запитання:
- •Тема 2.3. Лужні метали
- •Контрольні запитання:
- •Тема 2.4. Кальцій
- •Кальцій.**
- •Контрольні запитання:
- •Тема 2.5. Сполуки Кальцію
- •Контрольні запитання:
- •Тема 2.6. Алюміній
- •Контрольні запитання:
- •Тема 2.7. Залізо
- •Контрольні запитання:
- •Тема 2.8. Сульфур. Сірка.
- •Контрольні запитання:
- •Тема 2.9. Сполуки Сульфуру
- •Контрольні запитання:
- •Тема 2.10. Сульфатна кислота та її солі
- •Контрольні запитання:
- •Тема 2.11. Нітроген. Азот.
- •Контрольні запитання:
- •Тема 2.12. Аміак. Солі амонію.
- •Контрольні запитання:
- •Тема 2.13. Сполуки Нітрогену
- •Контрольні запитання:
- •Тема 2. 14.Фосфор
- •Фосфор.
- •Контрольні запитання:
- •Тема 2.15. Сполуки Фосфору
- •Контрольні запитання:
- •Тема 2.16. Карбон. Вуглець.
- •Контрольні запитання:
- •Тема 2.16. Сполуки Карбону
- •Контрольні запитання:
- •Тема 2.18. Силіцій.
- •Контрольні запитання:
- •Тема 2.19. Сполуки Силіцію.
- •Контрольні запитання:
- •Тема 3.1. Теорія будови органічних речовин о.М. Бутлерова
- •Контрольні запитання:
- •Тема 3.2. Алкани
- •Контрольні запитання:
- •Тема 3.3. Алкени
- •Контрольні запитання:
- •Тема 3.4. Алкіни
- •Контрольні запитання:
- •Тема 3.5. Алкадієни (дієнові вуглеводні)
- •Контрольні запитання:
- •Тема 3.6. Ароматичні вуглеводні (арени)
- •Контрольні запитання:
- •Тема 3.7. Природні джерела вуглеводнів
- •Контрольні запитання:
- •Тема 4.1. Одноатомні спирти
- •Контрольні запитання:
- •Тема 4.2. Багатоатомні спирти
- •Контрольні запитання:
- •Тема 4.3. Феноли
- •Контрольні запитання:
- •Тема 4.4. Альдегіди
- •Контрольні запитання:
- •Тема 4.5. Карбонові кислоти
- •Контрольні запитання:
- •Тема 4.6. Естери
- •2. Номенклатура:
- •Контрольні запитання:
- •Тема 4.7. Жири. Мило
- •Контрольні запитання:
- •Тема 5.1. Вуглеводи. Глюкоза
- •Контрольні запитання:
- •Тема 5.2. Сахароза
- •Контрольні запитання:
- •Тема 5.3. Крохмаль і целюлоза
- •Контрольні запитання:
- •Тема 5.4. Аміни
- •Контрольні запитання:
- •Тема 5.5. Амінокислоти
- •Контрольні запитання:
- •Тема 5.6. Білки
- •Контрольні запитання:
Контрольні запитання:
-
Які речовини називаються альдегідами? Загальна формула альдегідів.
-
У чому полягає різниця між альдегідами та кетонами?
-
Які види ізомерії характерні для альдегідів?
-
Які типи хімічних реакцій притаманні альдегідам?
-
Якісні реакції на альдегідну групу.
-
Скласти можливі ізомери для речовини складу С6Н12О. Дати назви всім сполукам.
-
Яку масу оцтової кислоти можна добути внаслідок реакції „срібного дзеркала”, якщо маса етаналю складає 146 г?. Масова часка виходу цієї реакції 80%.
Література:
-
Данильченко В.Є., Фрадіна Н.В. Хімія. 10 – 11 класи: Навч. посібник. – Х.: Країна мрій™, 2003. - с. 116-117.
-
Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. ІІІ, Гл. 17, §§ 146-148, с. 151-154.
-
Стахеєв О.Ю. Хімія. Узагальнюючі схеми і таблиці. – Тернопіль.: «Богдан», 1998. – с. 41.
-
Березан О.В. Органічна хімія. – К.: Абрис, 2000. – Р. V, §§ 1-4, с. 123-128.
Тема 4.5. Карбонові кислоти
План
-
Визначення та загальна формула класу.
-
Будова.
-
Номенклатура.*
-
Ізомерія.*
-
Фізичні властивості.
-
Хімічні властивості.**
-
Добування.*
-
Застосування.
1. Карбонові кислоти - це похідні вуглеводнів, що містять одну або декілька карбоксильних груп –СООН
Загальна формула насичених монокарбонових кислот: СnH2n+1СОOН або R–C=O
|
ОН
2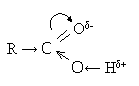 .
.
Взаємний вплив карбонілу –С=О і гідроксилу –ОН: зміщення електронів в С=О групі спричиняє зміщення електронів в ОН і поляризує зв'язок О←Н. В результаті: 1) посилення кислотності; 2) зростає міцність С=О, тому реакції приєднання відсутні; 3) зміцнення С–ОН, тому неможливо замістити ОН галогеном при взаємодії з галогеноводнями
3. Нумерація ланцюга здійснюється від карбоксильної групи. До назви відповідного алкану додається –ова і слово «кислота».
Н–CООН метанова кислота (мурашина кислота)
СН3–COОН етанова кислота (оцтова кислота)
С15Н31СООН – пальмітинова кислота
С17Н35СООН – стеаринова кислота
4. а) Структурна ізомерія карбонового скелета
б) Ізомерія з естерами:
О
||
С2Н5−СООН СН3−С−О–СН3
пропанова кислота метилетаноат
5. Перші три з насичених одноосновних карбонових кислот за звичайних умов – рідини з різким кислим запахом, добре розчинні у воді; наступні шість -- оліїсті рідини з неприємним запахом; вищі кислоти – тверді речовини. Між молекулами карбонових кислот встановлюються водневі зв'язки, причому за двома центрами, в результаті чого утворюються димери. Це приводить до зростання температур кипіння кислот порівняно зі спиртами.
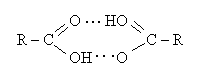
6. Хімічні властивості:
І. Горіння: СН3СООН + 2О2 → 2СО2 + 2Н2О
ІІ. Властивості кислот:
А) дисоціація: СН3СООН ↔ СН3СОО – + Н+
Б) взаємодія з металами, оксидами металів, основами:
2СН3СООН + Zn → (СН3СОО)2Zn + Н2
2СН3СООН + CaO → (СН3СОО)2Ca + Н2O
2СН3СООН + Ca(OH)2 → (СН3СОО)2Ca + 2Н2O
Б) взаємодія з солями більш слабких і летких кислот:
2СН3СООН + CaСO3 → (СН3СОО)2Ca + Н2O + СО2
ІІІ. Реакції естерифікації: СН3СООН +НОСН3 → СН3СООСН3 + Н2О
Метилетаноат
ІV. Заміщення Гідрогену в α-положенні на галоген:
СН3СООН +Cl2 → СН2СООH + НCl
|
Cl
Мурашина кислотаи – є альдегід кислотою, а тому дає реакцію «срібного дзеркала»:
tº
НО–C=O + Ag2O → СО2 + Н2О + 2Ag
|
H
-
Способи добування:
1) окиснення спиртів: C2H5OH + О2 → CH3−CООН + H2O
tº
2) окиснення альдегідів: СН3–C=O + Ag2O → CH3−C=O + 2Ag
| |
H OH
3) окиснення алканів: 2С4Н10 + 5О2 → 4СН3СООН + 2Н2О
tº [О]
4) з ацетилену: СН≡СН + Н2O → CH3−C=O → CH3−C=O
| |
H ОН
8. Мурашина кислота: 1) як розчинник;
2) у медицині (мурашиний спирт);
3) як відновник;
Оцтова кислота: 1) 6 – 9% розчин - оцет;
2) як розчинник
3) для виробництва ацетатного волокна
4) синтез барвників, ліків
5) виробництво пестицидів
