
- •Тема 1.1. Основні закони хімії
- •Закон збереження маси речовини
- •Контрольні запитання:
- •Тема 1.2. Оксиди
- •Визначення. Класифікація оксидів.
- •Контрольні запитання:
- •Тема 1.3. Основи
- •Визначення. Класифікація основ.
- •Контрольні запитання:
- •Тема 1.4. Кислоти
- •Визначення. Класифікація кислот.
- •Контрольні запитання:
- •Тема 1.5. Солі
- •Визначення. Класифікація солей.
- •Контрольні запитання:
- •Тема 1.6. Хімічний зв'язок
- •Поняття про хімічний зв'язок. Типи хімічного зв’язку.
- •Контрольні запитання:
- •Тема 1.7. Електролітична дисоціація. Реакції йонного обміну
- •Контрольні запитання:
- •Тема 1.8. Окисно-відновні реакції
- •Контрольні запитання:
- •Тема 2.1. Загальна характеристика металів
- •Контрольні запитання:
- •Тема 2.2. Корозія металів
- •Корозія металів. Види корозії.
- •Контрольні запитання:
- •Тема 2.3. Лужні метали
- •Контрольні запитання:
- •Тема 2.4. Кальцій
- •Кальцій.**
- •Контрольні запитання:
- •Тема 2.5. Сполуки Кальцію
- •Контрольні запитання:
- •Тема 2.6. Алюміній
- •Контрольні запитання:
- •Тема 2.7. Залізо
- •Контрольні запитання:
- •Тема 2.8. Сульфур. Сірка.
- •Контрольні запитання:
- •Тема 2.9. Сполуки Сульфуру
- •Контрольні запитання:
- •Тема 2.10. Сульфатна кислота та її солі
- •Контрольні запитання:
- •Тема 2.11. Нітроген. Азот.
- •Контрольні запитання:
- •Тема 2.12. Аміак. Солі амонію.
- •Контрольні запитання:
- •Тема 2.13. Сполуки Нітрогену
- •Контрольні запитання:
- •Тема 2. 14.Фосфор
- •Фосфор.
- •Контрольні запитання:
- •Тема 2.15. Сполуки Фосфору
- •Контрольні запитання:
- •Тема 2.16. Карбон. Вуглець.
- •Контрольні запитання:
- •Тема 2.16. Сполуки Карбону
- •Контрольні запитання:
- •Тема 2.18. Силіцій.
- •Контрольні запитання:
- •Тема 2.19. Сполуки Силіцію.
- •Контрольні запитання:
- •Тема 3.1. Теорія будови органічних речовин о.М. Бутлерова
- •Контрольні запитання:
- •Тема 3.2. Алкани
- •Контрольні запитання:
- •Тема 3.3. Алкени
- •Контрольні запитання:
- •Тема 3.4. Алкіни
- •Контрольні запитання:
- •Тема 3.5. Алкадієни (дієнові вуглеводні)
- •Контрольні запитання:
- •Тема 3.6. Ароматичні вуглеводні (арени)
- •Контрольні запитання:
- •Тема 3.7. Природні джерела вуглеводнів
- •Контрольні запитання:
- •Тема 4.1. Одноатомні спирти
- •Контрольні запитання:
- •Тема 4.2. Багатоатомні спирти
- •Контрольні запитання:
- •Тема 4.3. Феноли
- •Контрольні запитання:
- •Тема 4.4. Альдегіди
- •Контрольні запитання:
- •Тема 4.5. Карбонові кислоти
- •Контрольні запитання:
- •Тема 4.6. Естери
- •2. Номенклатура:
- •Контрольні запитання:
- •Тема 4.7. Жири. Мило
- •Контрольні запитання:
- •Тема 5.1. Вуглеводи. Глюкоза
- •Контрольні запитання:
- •Тема 5.2. Сахароза
- •Контрольні запитання:
- •Тема 5.3. Крохмаль і целюлоза
- •Контрольні запитання:
- •Тема 5.4. Аміни
- •Контрольні запитання:
- •Тема 5.5. Амінокислоти
- •Контрольні запитання:
- •Тема 5.6. Білки
- •Контрольні запитання:
Контрольні запитання:
-
Які властивості характерні для кальцій оксиду?
-
Які властивості характерні для кальцій гідроксиду?
-
Що називають твердістю води?
-
Чим зумовлена карбонатна твердість?
-
Способи усунення карбонатної твердості.
-
Чим зумовлена некарбонатна твердість?
-
Способи усунення карбонатної твердості.
-
Барій кількістю речовини 0,05 моль помістили в 500 г розчину з масовою часткою барій гідроксиду 8%. Обчисліть масову частку розчиненої речовини в новоутвореному розчині.
Література:
-
Данильченко В.Є., Фрадіна Н.В. Хімія. 8 – 9 класи: Навч. посібник. – Х.: Країна мрій™, 2003. - с. 165.
-
Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. ІІ, Гл. 13, §§ 107-109, с. 117-119.
-
Стахеєв О.Ю. Хімія. Узагальнюючі схеми і таблиці. – Тернопіль: «Богдан», 1998. – с. 19.
Тема 2.6. Алюміній
План
-
Загальна характеристика елементів ІІІ-А групи періодичної системи. Алюміній як хімічний елемент.
-
Фізичні властивості алюмінію.
-
Хімічні властивості.**
-
Добування та застосування.*
-
Сполуки Алюмінію.**
1. До ІІІ-А групи входять елементи B, Al, Ga, In, Tl. Електронна конфігурація зовнішнього енергетичного рівня їх атомів - ns2np1. Це – р-елементи. У складних речовинах вони виявляють ступінь окиснення +3 (Бор також –3, а Талій +1).
Зі збільшенням радіуса їх атомів металічні властивості посилюються: Бор – неметалічний елемент, Алюміній – металічний елемент, але не типовий (його оксид і гідроксид – амфотерні), а Талій вже типовий металічний елемент, близький за властивостями до лужних та лужноземельних металів. На відміну від них у елементів ІІІ-А групи нема тенденції до посилення реакційної здатності.
Формула оксидів цих елементів Е2О3 , гідроксидів - Е(ОН)3
2. Електронна конфігурація атома Алюмінію 1s22s22p63s23p1, це – р-елемент. На зовнішньому енергетичному рівні він має три валенті електрони та вільні р-орбіталі. Це означає, що атом Алюмінію може переходити у збуджений стан:
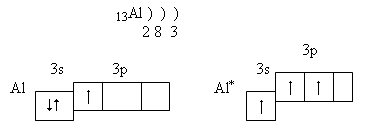
У збудженому стані атом Алюмінію може утворювати три ковалентні зв’язки або віддавати три валентні електрони, виявляючи ступінь окиснення +3. Отже, в окисно-відновних реакціях Алюміній поводить себе як відновник.
У природі Алюміній дуже поширений, трапляється тільки у вигляді алюмосилікатів. Це різні глини, слюда, польовий шпат, каолін тощо. Основною алюмінієвою рудою є боксит Al2O3·nH2O, кріоліт Na3[AlF6] і корунд (глинозем) Al2O3.
3. Фізичні властивості: алюміній – сріблясто-білий метал, доволі легкоплавкий tпл = 660oC, і дуже легкий ρ = 2,7 г/см3. Має високу електричну і теплову провідність, дуже пластичний.
4. Алюміній – активний метал. Його поверхня вкрита тонкою, щільною і дуже міцною оксидною плівкою Al2O3, яка захищає його від подальшого окиснення і зумовлює високу корозійну стійкість.
1) з водою: 2Al + 6Н2O = 2Al(OН)3 + 3Н2
2) з неметалами: 4Al + 3O2 = 2Al2O3
4Al + 3Cl2 = 2AlCl3
3) за стандартних умов реагує з хлоридною і розбавленою сульфатною кислотою:
![]()
Концентровані сульфатна й нітратна кислоти пасивують алюміній: під дією цих кислот збільшується товщина оксидної плівки на металі, і він не взаємодіє з ними.
4) з лугами завдяки легкості розчинення в них оксидної плівки:
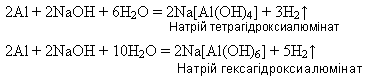
5) алюміній – добрий відновник багатьох оксидів металів:
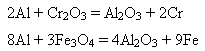
5. Добування алюмінію: спочатку з бокситу добувають глинозем, а потім електролізом розчину алюміній оксиду у розплавленому криоліті Na3[AlF6] добувають металічний алюміній.
Застосування: алюміній за використанням у промисловості посідає друге місце після заліза. Основна маса його йде на виготовлення сплавів – дюраль, або дюралюміній. Це сплав алюмінію з міддю і невеликими кількостями магнію, мангану та інших компонентів. Використовується як конструкційний матеріал в авіа- і машинобудуванні, як розкисник (вилучає надлишковий кисень) під час виплавляння сталі, для добування кальцію, барію, мангану, хрому алюмінотермічним способом, для виготовлення фольги у виробництві конденсаторів, у радіотехніці та для упакування шоколаду, чаю, інших продуктів і виготовлення алюмінієвого дроту, “срібної” фарби. Зі сплавів алюмінію роблять різні предмети побуту.
6. До основних сполук Алюмінію належать алюміній оксид та алюміній гідроксид. За хімічними властивостями це амфотерні речовини:
1) Тільки свіжодобутий алюміній оксид розчиняється в кислотах і лугах:
![]()
Під час сплавляння з лугами також утворюються алюмінати:
![]()
2) Свіжоосаджений алюміній гідроксид взаємодіє і з кислотами, і з лугами:
![]()
![]()
Під час сплавляння утворюються або мета-, або ортоалюмінат:
![]()
