
- •Тема 1.1. Основні закони хімії
- •Закон збереження маси речовини
- •Контрольні запитання:
- •Тема 1.2. Оксиди
- •Визначення. Класифікація оксидів.
- •Контрольні запитання:
- •Тема 1.3. Основи
- •Визначення. Класифікація основ.
- •Контрольні запитання:
- •Тема 1.4. Кислоти
- •Визначення. Класифікація кислот.
- •Контрольні запитання:
- •Тема 1.5. Солі
- •Визначення. Класифікація солей.
- •Контрольні запитання:
- •Тема 1.6. Хімічний зв'язок
- •Поняття про хімічний зв'язок. Типи хімічного зв’язку.
- •Контрольні запитання:
- •Тема 1.7. Електролітична дисоціація. Реакції йонного обміну
- •Контрольні запитання:
- •Тема 1.8. Окисно-відновні реакції
- •Контрольні запитання:
- •Тема 2.1. Загальна характеристика металів
- •Контрольні запитання:
- •Тема 2.2. Корозія металів
- •Корозія металів. Види корозії.
- •Контрольні запитання:
- •Тема 2.3. Лужні метали
- •Контрольні запитання:
- •Тема 2.4. Кальцій
- •Кальцій.**
- •Контрольні запитання:
- •Тема 2.5. Сполуки Кальцію
- •Контрольні запитання:
- •Тема 2.6. Алюміній
- •Контрольні запитання:
- •Тема 2.7. Залізо
- •Контрольні запитання:
- •Тема 2.8. Сульфур. Сірка.
- •Контрольні запитання:
- •Тема 2.9. Сполуки Сульфуру
- •Контрольні запитання:
- •Тема 2.10. Сульфатна кислота та її солі
- •Контрольні запитання:
- •Тема 2.11. Нітроген. Азот.
- •Контрольні запитання:
- •Тема 2.12. Аміак. Солі амонію.
- •Контрольні запитання:
- •Тема 2.13. Сполуки Нітрогену
- •Контрольні запитання:
- •Тема 2. 14.Фосфор
- •Фосфор.
- •Контрольні запитання:
- •Тема 2.15. Сполуки Фосфору
- •Контрольні запитання:
- •Тема 2.16. Карбон. Вуглець.
- •Контрольні запитання:
- •Тема 2.16. Сполуки Карбону
- •Контрольні запитання:
- •Тема 2.18. Силіцій.
- •Контрольні запитання:
- •Тема 2.19. Сполуки Силіцію.
- •Контрольні запитання:
- •Тема 3.1. Теорія будови органічних речовин о.М. Бутлерова
- •Контрольні запитання:
- •Тема 3.2. Алкани
- •Контрольні запитання:
- •Тема 3.3. Алкени
- •Контрольні запитання:
- •Тема 3.4. Алкіни
- •Контрольні запитання:
- •Тема 3.5. Алкадієни (дієнові вуглеводні)
- •Контрольні запитання:
- •Тема 3.6. Ароматичні вуглеводні (арени)
- •Контрольні запитання:
- •Тема 3.7. Природні джерела вуглеводнів
- •Контрольні запитання:
- •Тема 4.1. Одноатомні спирти
- •Контрольні запитання:
- •Тема 4.2. Багатоатомні спирти
- •Контрольні запитання:
- •Тема 4.3. Феноли
- •Контрольні запитання:
- •Тема 4.4. Альдегіди
- •Контрольні запитання:
- •Тема 4.5. Карбонові кислоти
- •Контрольні запитання:
- •Тема 4.6. Естери
- •2. Номенклатура:
- •Контрольні запитання:
- •Тема 4.7. Жири. Мило
- •Контрольні запитання:
- •Тема 5.1. Вуглеводи. Глюкоза
- •Контрольні запитання:
- •Тема 5.2. Сахароза
- •Контрольні запитання:
- •Тема 5.3. Крохмаль і целюлоза
- •Контрольні запитання:
- •Тема 5.4. Аміни
- •Контрольні запитання:
- •Тема 5.5. Амінокислоти
- •Контрольні запитання:
- •Тема 5.6. Білки
- •Контрольні запитання:
Контрольні запитання:
-
Дайте характеристику елементам ІІІ-А групи.
-
Які фізичні властивості характерні для алюмінію?
-
Які хімічні властивості характерні для алюмінію та його сполук?
-
Які добувають алюміній?
-
Назвіть природні сполуки алюмінію.
-
Яке практичне значення алюмінію?
-
Яку масу алюміній сульфіду можна добути з 5,4 г алюмінію і 16 г сірки?
Література:
-
Данильченко В.Є., Фрадіна Н.В. Хімія. 8 – 9 класи: Навч. посібник. – Х.: Країна мрій™, 2003. - с. 167-168.
-
Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. ІІ, Гл. 13, §§ 110-113, с. 119-121.
-
Стахеєв О.Ю. Хімія. Узагальнюючі схеми і таблиці. – Тернопіль: «Богдан», 1998. – с. 20.
Тема 2.7. Залізо
План
-
Ферум.
-
Фізичні властивості заліза.
-
Хімічні властивості заліза.**
-
Добування та застосування заліза.*
-
Сполуки Феруму.*
-
Якісні реакція на катіони Fe2+ i Fe3+.**
1. Ферум – d-елемент VІІІ-В групи періодичної системи.
Будова атома:
![]()
Електронна конфігурація атома Феруму: 1s22s22p63s23p63d64s2
Найхарактерніші ступені окиснення +2 і +3 (відомі сполуки, де Ферум виявляє ступені окиснення, що дорівнюють 0, +6).
За поширенням у природі Ферум посідає четверте місце після Оксигену, Силіцію, Алюмінію. Трапляється у вигляді різних сполук: оксидів, сульфідів, силікатів та ін. У вільному стані – тільки в метеоритах. Основні мінерали, що містять Ферум:

2. Чисте залізо – сріблясто-білий блискучий метал, пластичний, відносно м’який, легко кується, прокатується, зварюється. Густина заліза ρ = 7,87 г/см3, температура плавлення tпл=1535oС. Має здатність намагнічуватися.
3. Залізо належить до металів середньої хімічної активності:
1) взаємодіє з киснем: 3Fe + 2O2 → Fe3O4
2) під час нагрівання взаємодіє з іншими неметалами – хлором, сіркою, вуглецем, азотом: 2Fe + 3Cl2 → 2FeCl3
3) у розжареному стані (понад 700ºС) взаємодіє з водою (водяною парою):
3Fe + 4H2O → Fe3O4 + 4H2
4) На вологому повітрі та у воді, яка містить кисень, залізо зазнає корозії, воно іржавіє, вкриваючись жовто-бурою плівкою, яка переважно складається із ферум (ІІІ) гідроксиду, але плівка не захищає метал від подальшої корозії:
4Fe + 6H2O + 3O2 → 4Fe(OH)3
5) взаємодіє з хлоридною і розбавленою сульфатною кислотами:
Fe + 2HCl → FeCl2 + H2
Концентрована (безводна) сульфатна кислота пасивує залізо, що дає змогу зберігати і перевозити її у залізних цистернах. Концентрована нітратна кислота також пасивує залізо.
6) Залізо відновлює менш активні метали з розчинів їхніх солей:
Fe + CuSO4 = FeSO4 + Cu
4. Способи добування заліза:
1) відновлення з оксидів (доменний процес)
2) алюмінотермія
3) електроліз водних розчинів солей Fe (ІІ).
Застосування заліза: 1) як каталізатор в хімічній промисловості;
2) сплави заліза (чавун і сталь) є основними конструкційними матеріалами;
5. Ферум утворює три оксиди і два гідроксиди:

Ферум (ІІ) оксид і ферум (ІІ) гідроксид виявляють основні властивості:
FeO + 2HCl = FeCl2 + H2O
Fe(OH)2 + H2SO4 = FeSO4 + H2O
Крім цього Fe(OH)2 легко окиснюється до Fe(OH)3:
4 Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3
Ферум (ІІІ) оксид і ферум (ІІІ) гідроксид мають амфотерні властивості:
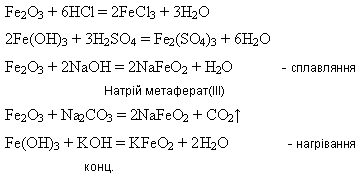
Гідроксиди феруму (ІІ) і (ІІІ) під час нагрівання розкладаються:
2Fe(OH)3 = Fe2O3 + 3H2O
Fe(OH)2 = FeO + H2O
Ферум (ІІ, ІІІ) оксид під час взаємодії з кислотами утворює суміш двох солей – Феруму (ІІ) і Феруму (ІІІ):
Fe3O4 + 8HCl = 2FeCl3 + FeCl2 + 4H2O
Fe3O4 + 4H2SO4 = Fe2(SO4)3 + FeSO4 + 4H2O
6. Якісна реакція на Fe2+: взаємодія з червоною кров’яною сіллю K3[Fe(CN)6] - калій гексаціаноферратом (ІІІ), яка під час взаємодії з солями Феруму(ІІ) дає осад синього кольору – турнбулеву синь:
3FeCl2 + 2K3[Fe(CN)6] → Fe3[Fe(CN)6]2 + 6KCl
Якісні реакції на Fe3+:
1) взаємодія з жовтою кров’яною сіллю K4[Fe(CN)6] - калій гексаціаноферратом (ІІ), яка під час взаємодії з солями Феруму (ІІІ) дає осад синього кольору – берлінську лазур:
4FeCl3 + 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3 + 12KCl
2) взаємодія з амоній роданідом NH4SCN або калій роданідом KSCN. Утворюється сполука темно-червоного кольору:
FeCl3 + 3KSCN→ Fe(SCN)3 + 3KCl
