
- •Тема 1.1. Основні закони хімії
- •Закон збереження маси речовини
- •Контрольні запитання:
- •Тема 1.2. Оксиди
- •Визначення. Класифікація оксидів.
- •Контрольні запитання:
- •Тема 1.3. Основи
- •Визначення. Класифікація основ.
- •Контрольні запитання:
- •Тема 1.4. Кислоти
- •Визначення. Класифікація кислот.
- •Контрольні запитання:
- •Тема 1.5. Солі
- •Визначення. Класифікація солей.
- •Контрольні запитання:
- •Тема 1.6. Хімічний зв'язок
- •Поняття про хімічний зв'язок. Типи хімічного зв’язку.
- •Контрольні запитання:
- •Тема 1.7. Електролітична дисоціація. Реакції йонного обміну
- •Контрольні запитання:
- •Тема 1.8. Окисно-відновні реакції
- •Контрольні запитання:
- •Тема 2.1. Загальна характеристика металів
- •Контрольні запитання:
- •Тема 2.2. Корозія металів
- •Корозія металів. Види корозії.
- •Контрольні запитання:
- •Тема 2.3. Лужні метали
- •Контрольні запитання:
- •Тема 2.4. Кальцій
- •Кальцій.**
- •Контрольні запитання:
- •Тема 2.5. Сполуки Кальцію
- •Контрольні запитання:
- •Тема 2.6. Алюміній
- •Контрольні запитання:
- •Тема 2.7. Залізо
- •Контрольні запитання:
- •Тема 2.8. Сульфур. Сірка.
- •Контрольні запитання:
- •Тема 2.9. Сполуки Сульфуру
- •Контрольні запитання:
- •Тема 2.10. Сульфатна кислота та її солі
- •Контрольні запитання:
- •Тема 2.11. Нітроген. Азот.
- •Контрольні запитання:
- •Тема 2.12. Аміак. Солі амонію.
- •Контрольні запитання:
- •Тема 2.13. Сполуки Нітрогену
- •Контрольні запитання:
- •Тема 2. 14.Фосфор
- •Фосфор.
- •Контрольні запитання:
- •Тема 2.15. Сполуки Фосфору
- •Контрольні запитання:
- •Тема 2.16. Карбон. Вуглець.
- •Контрольні запитання:
- •Тема 2.16. Сполуки Карбону
- •Контрольні запитання:
- •Тема 2.18. Силіцій.
- •Контрольні запитання:
- •Тема 2.19. Сполуки Силіцію.
- •Контрольні запитання:
- •Тема 3.1. Теорія будови органічних речовин о.М. Бутлерова
- •Контрольні запитання:
- •Тема 3.2. Алкани
- •Контрольні запитання:
- •Тема 3.3. Алкени
- •Контрольні запитання:
- •Тема 3.4. Алкіни
- •Контрольні запитання:
- •Тема 3.5. Алкадієни (дієнові вуглеводні)
- •Контрольні запитання:
- •Тема 3.6. Ароматичні вуглеводні (арени)
- •Контрольні запитання:
- •Тема 3.7. Природні джерела вуглеводнів
- •Контрольні запитання:
- •Тема 4.1. Одноатомні спирти
- •Контрольні запитання:
- •Тема 4.2. Багатоатомні спирти
- •Контрольні запитання:
- •Тема 4.3. Феноли
- •Контрольні запитання:
- •Тема 4.4. Альдегіди
- •Контрольні запитання:
- •Тема 4.5. Карбонові кислоти
- •Контрольні запитання:
- •Тема 4.6. Естери
- •2. Номенклатура:
- •Контрольні запитання:
- •Тема 4.7. Жири. Мило
- •Контрольні запитання:
- •Тема 5.1. Вуглеводи. Глюкоза
- •Контрольні запитання:
- •Тема 5.2. Сахароза
- •Контрольні запитання:
- •Тема 5.3. Крохмаль і целюлоза
- •Контрольні запитання:
- •Тема 5.4. Аміни
- •Контрольні запитання:
- •Тема 5.5. Амінокислоти
- •Контрольні запитання:
- •Тема 5.6. Білки
- •Контрольні запитання:
Контрольні запитання:
-
Наведіть структурну і молекулярну формулу аміаку.
-
Поясніть будову аміаку?
-
Які фізичні та хімічні властивості характерні для аміаку?
-
Наведіть оптимальні умови для промислового синтезу аміаку.
-
Де використовуються аміак і солі амонію?
-
Який об’єм аміаку витрачається для добування аміачної селітри масою 84 г, якщо вихід продукту реакції складає 85%.
-
Визначте який об’єм аміака необхідно розчинити за н.у. у воді масою 200 г, щоб отримати розчин нашатирного спирту з масовою часткою NH310%.
Література:
-
Данильченко В.Є., Фрадіна Н.В. Хімія. 10 – 11 класи: Навч. посібник. – Х.: Країна мрій™, 2003. - с. 23-24.
-
Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. ІІ, Гл. 10, § 80, с. 94-96.
-
Стахеєв О.Ю. Хімія. Узагальнюючі схеми і таблиці. – Тернопіль.: «Богдан», 1998. – с. 28.
Тема 2.13. Сполуки Нітрогену
План
-
Оксиди Нітрогену.**
-
Нітратна кислота.**
-
Нітрати.*
1. Нітроген з Оксигеном утворює п’ять оксидів, в яких він виявляє різні ступені окиснення від +1 до +5. Різний кількісний склад оксидів і різна їх будова зумовлюють їх різні властивості. Усі оксиди Нітрогену дуже отруйні, за винятком нітроген (І) оксиду.
|
Оксид |
Ступінь окиснення Нітрогену |
Характер оксиду
|
Агрегатний стан |
Добування
|
|
N2O |
+1 |
Несолетворний |
Безбарвний газ |
|
|
NO
|
+2 |
Несолетворний |
Безбарвний газ |
|
|
N2O3 |
+3 |
Кислотний |
Синя рідина |
NO + NO2 = N2O3 |
|
NO2 N2O4 |
+4 |
Кислотний |
Бурий газ Безбарвна тверда речовина |
2NO + O2 = 2 NO2 2NO2↔ N2O4 |
|
N2O5 |
+5 |
Кислотний |
Біла тверда речовина |
2HNO3 + P2O5= N2O5 + 2HPO3 |
Хімічні властивості:
1) Нітроген (ІІ) оксид на повітрі легко окиснюється і переходить у бурий газ:
2NO + O2 = 2NO2
2) Нітроген (ІІІ) оксид взаємодіє з водою з утворенням нітритної кислоти:
N2O3 + H2O = 2HNO2
3) Нітроген (IV)оксид (бурий газ) взаємодіє з водою з утворенням двох кислот – нітратної і нітритної:
2NO2 + H2O = HNO3 + HNO2
За наявності надлишку кисню у воді утворюється тільки нітратна кислота:
![]()
Бурий газ, що міститься у відхідних газах („лисячий хвіст”), шкідливих для всього живого, тепер розкладають за допомогою каталізатора:
![]()
4) Нітроген (V) оксид взаємодіє з водою з утворенням нітратної кислоти:
![]()
2. Молекулярна формула нітратної кислоти HNO3.
Структурна формула:
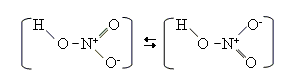
Валентність Нітрогену в нітратній кислоті дорівнює IV, а ступінь окиснення +5.
Фізичні властивості: Безводна нітратна кислота – безбарвна летка рідина з різким запахом, на повітрі „димить”, дуже добре розчиняється у воді, змішуючись з нею у будь-яких співвідношеннях.
Хімічні властивості: Нітратна кислота належить до сильних одноосновних кислот.
1) У водному розчині вона повністю дисоціює на йони:
![]()
2) взаємодіє з основними оксидами та основами:
![]()
3) взаємодіє з обмеженою кількістю солей, оскільки нітратна кислота хоч і сильна, але летка:
![]()
4) Розкладається під час нагрівання і під впливом світла:
![]()
5) Взаємодіє з металами. Як сильний окисник нітратна кислота окиснює майже всі метали (за винятком золота, платини та ін.). При цьому водень не виділяється, бо відновлюється Нітроген, а не Гідроген. Продукти відновлення можуть бути різні: NO2 , NO, N2O, N2 або NH3 , який з нітратною кислотою утворює сіль амоній нітрат.
Концентрована нітратна кислота не діє на залізо, хром, алюміній, платину, золото, тантал. З іншими важкими металами вона взаємодіє з утворенням NO2:
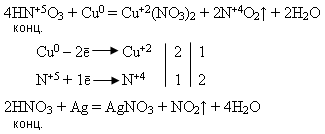
З лужними та лужноземельними металами нітратна кислота відновлюється до нітроген (І) оксиду.
Розбавлена нітратна кислота не взаємодіє з платиною, золотом. З іншими важкими металами взаємодіє, утворюючи NO. Внаслідок взаємодії з лужними, лужноземельними металами, а також оловом і залізом утворюється амоній нітрат:
6) Взаємодіє з неметалами. Сірку вона окиснює до сульфатної кислоти, фосфор – до фосфатної, а сама відновлюється до NO (розбавлена) і до NO2 (концентрована):
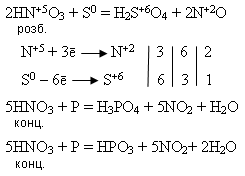
Добування: У лабораторії нітратну кислоту одержують дією концентрованої сульфатної кислоти на сухі нітрати:
![]()
У промисловості нітратну кислоту добувають аміачним способом, який складається з таких стадій:
І) окиснення амоніаку до NO:
![]()
ІІ) окиснення NO киснем повітря до NO2:
![]()
ІІІ) поглинання NO2 водою за наявності надлишку кисню:
![]()
Застосування: для виробництва добрив, барвників, пороху та інших вибухових речовин, пластмас, штучного волокна, лікарських препаратів, піно- та фотоплівки; як сильний окисник у самозаймистих ракетних паливах.
3. Нітрати – тверді кристалічні речовини з йонним типом зв’язку, добре розчиняються у воді, усі отруйні. Нітрати Калію, Натрію, Кальцію та амонію називають селітрами.
Характерною хімічною властивістю нітратів є їхня здатність розкладатися під час нагрівання (термоліз) з виділенням кисню (за винятком амоній нітрату, внаслідок термолізу якого кисень не утворюється). Продукти термолізу залежать від природи металу, який входить до складу солі, від його місця в ряду активності металів:
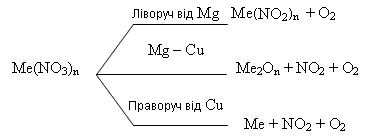
Якісна реакція на нітрати полягає у виділенні бурого газу NO2 під час нагрівання з концентрованою сульфатною кислотою і міддю:
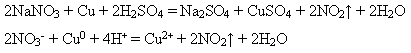
Нітрати можна добути дією нітратної кислоти на метали, оксиди металів, основи, амоніак, деякі солі тощо:
Застосування: Нітрати використовують у сільському господарстві як добрива, у піротехніці для виготовлення чорного пороху та вибухових речовин. Окрім того, натрій нітрат та калій нітрат також використовують у варінні скла і в харчовій промисловості для консервування продуктів.
