
- •Тема 1.1. Основні закони хімії
- •Закон збереження маси речовини
- •Контрольні запитання:
- •Тема 1.2. Оксиди
- •Визначення. Класифікація оксидів.
- •Контрольні запитання:
- •Тема 1.3. Основи
- •Визначення. Класифікація основ.
- •Контрольні запитання:
- •Тема 1.4. Кислоти
- •Визначення. Класифікація кислот.
- •Контрольні запитання:
- •Тема 1.5. Солі
- •Визначення. Класифікація солей.
- •Контрольні запитання:
- •Тема 1.6. Хімічний зв'язок
- •Поняття про хімічний зв'язок. Типи хімічного зв’язку.
- •Контрольні запитання:
- •Тема 1.7. Електролітична дисоціація. Реакції йонного обміну
- •Контрольні запитання:
- •Тема 1.8. Окисно-відновні реакції
- •Контрольні запитання:
- •Тема 2.1. Загальна характеристика металів
- •Контрольні запитання:
- •Тема 2.2. Корозія металів
- •Корозія металів. Види корозії.
- •Контрольні запитання:
- •Тема 2.3. Лужні метали
- •Контрольні запитання:
- •Тема 2.4. Кальцій
- •Кальцій.**
- •Контрольні запитання:
- •Тема 2.5. Сполуки Кальцію
- •Контрольні запитання:
- •Тема 2.6. Алюміній
- •Контрольні запитання:
- •Тема 2.7. Залізо
- •Контрольні запитання:
- •Тема 2.8. Сульфур. Сірка.
- •Контрольні запитання:
- •Тема 2.9. Сполуки Сульфуру
- •Контрольні запитання:
- •Тема 2.10. Сульфатна кислота та її солі
- •Контрольні запитання:
- •Тема 2.11. Нітроген. Азот.
- •Контрольні запитання:
- •Тема 2.12. Аміак. Солі амонію.
- •Контрольні запитання:
- •Тема 2.13. Сполуки Нітрогену
- •Контрольні запитання:
- •Тема 2. 14.Фосфор
- •Фосфор.
- •Контрольні запитання:
- •Тема 2.15. Сполуки Фосфору
- •Контрольні запитання:
- •Тема 2.16. Карбон. Вуглець.
- •Контрольні запитання:
- •Тема 2.16. Сполуки Карбону
- •Контрольні запитання:
- •Тема 2.18. Силіцій.
- •Контрольні запитання:
- •Тема 2.19. Сполуки Силіцію.
- •Контрольні запитання:
- •Тема 3.1. Теорія будови органічних речовин о.М. Бутлерова
- •Контрольні запитання:
- •Тема 3.2. Алкани
- •Контрольні запитання:
- •Тема 3.3. Алкени
- •Контрольні запитання:
- •Тема 3.4. Алкіни
- •Контрольні запитання:
- •Тема 3.5. Алкадієни (дієнові вуглеводні)
- •Контрольні запитання:
- •Тема 3.6. Ароматичні вуглеводні (арени)
- •Контрольні запитання:
- •Тема 3.7. Природні джерела вуглеводнів
- •Контрольні запитання:
- •Тема 4.1. Одноатомні спирти
- •Контрольні запитання:
- •Тема 4.2. Багатоатомні спирти
- •Контрольні запитання:
- •Тема 4.3. Феноли
- •Контрольні запитання:
- •Тема 4.4. Альдегіди
- •Контрольні запитання:
- •Тема 4.5. Карбонові кислоти
- •Контрольні запитання:
- •Тема 4.6. Естери
- •2. Номенклатура:
- •Контрольні запитання:
- •Тема 4.7. Жири. Мило
- •Контрольні запитання:
- •Тема 5.1. Вуглеводи. Глюкоза
- •Контрольні запитання:
- •Тема 5.2. Сахароза
- •Контрольні запитання:
- •Тема 5.3. Крохмаль і целюлоза
- •Контрольні запитання:
- •Тема 5.4. Аміни
- •Контрольні запитання:
- •Тема 5.5. Амінокислоти
- •Контрольні запитання:
- •Тема 5.6. Білки
- •Контрольні запитання:
Контрольні запитання:
-
Що є предметом вивчення органічної хімії?
-
Які речовини називають органічними?
-
Якими особливостями володіють органічні сполуки?
-
Сформулюйте основні положення теорії О.М. Бутлерова.
Література:
-
Данильченко В.Є., Фрадіна Н.В. Хімія. 10 – 11 класи: Навч. посібник. – Х.: Країна мрій™, 2003. - с. 54.
-
Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. ІІІ, Гл. 15, §§ 124-127, с. 130-132.
-
Березан О.В. Органічна хімія. – К.: Абрис, 2000. – Р. І, § 1, с. 7.
Тема 3.2. Алкани
План
-
Визначення та загальна формула класу.
-
Будова.*
-
Номенклатура.*
-
Ізомерія.*
-
Фізичні властивості.
-
Хімічні властивості.**
-
Добування.*
-
Застосування.
1. Вуглеводні – сполуки, до складу яких входять атоми Карбону й Гідрогену (від раніше вживаних назв елементів – вуглець і водень).
Насичені вуглеводні – ті, в яких валентності атомів Карбону повністю насичені атомами Гідрогену. Міжнародна назва насичених вуглеводнів – алкани, їх називають також парафіни.
Загальна формула алканів CnH2n+2
Сполуки, що мають подібну будову молекул і подібні хімічні властивості й різняться між собою за складом на одну чи кілька групп –CH2, називають гомологами, а ряд сполук – гомологічним рядом. Група –CH2– гомологічна різниця ряду.
2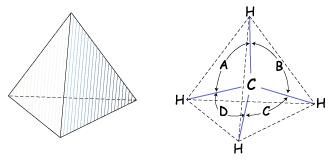 .
Молекула метану
має форму правильної тригональної
піраміди (тетраедра). Якщо атом Карбону
вписати в центр цієї геометричної
фігури, то чотири валентні зв'язки
спрямуються під кутом 109,5
.
Молекула метану
має форму правильної тригональної
піраміди (тетраедра). Якщо атом Карбону
вписати в центр цієї геометричної
фігури, то чотири валентні зв'язки
спрямуються під кутом 109,5![]() до вершин, де розміщені атоми Гідрогену
.
до вершин, де розміщені атоми Гідрогену
.
Така будова молекули метану зумовлена електронною будовою атома Карбону. У збудженому стані атом Карбону має чотири неспарені валентні електрони
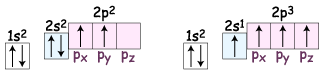 У момент утворення молекули метану
електронні
хмари одного s-
і трьох p-електронів
гібридизуються (змішуються) і в результаті
утворюються чотири нові рівноцінні
гібридизовані електронні хмари, що
мають форму несиметричних вісімок,
витягнутих у напрямку від центра до
вершини тетраедра під кутом одна до
одної 109,5
У момент утворення молекули метану
електронні
хмари одного s-
і трьох p-електронів
гібридизуються (змішуються) і в результаті
утворюються чотири нові рівноцінні
гібридизовані електронні хмари, що
мають форму несиметричних вісімок,
витягнутих у напрямку від центра до
вершини тетраедра під кутом одна до
одної 109,5![]() .
Такий вид гібридизації називають
sp
.
Такий вид гібридизації називають
sp![]() -гібридизацією
-гібридизацією
Довжина зв’язків С—С становить 0,154 нм
Завдяки тетраедричній будові атомів Карбону молекули алканів мають форму зигзагоподібного ланцюга.
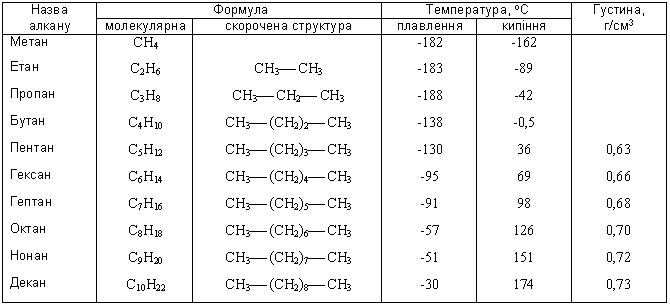
3. Таблиця. Гомологічний ряд метану
Номенклатура:
1) вибрати найдовший ланцюг;
2) визначити замісники;
3) пронумерувати найдовший ланцюг, починаючи з того кінця, до якого ближче відгалуження;
4) перед назвою вуглеводню зазначається цифрами місце радикалів та їх назва за алфавітом.
6 5 4 3 2 1
СН3 −СН2−СН−СН−СН2−СН3
| |
СН3 C2H5
3-етил-4-метилгексан
4. Алканам властива структурна ізомерія карбонового скелета
А) н-бутан Б) метилпропан
СН3-СН2-СН2-СН3 СН3-СН-СН3
|
СН3
5. Перші чотири речовини за н.у.– гази без запаху, далі йдуть рідини з характерним запахом, а починаючи з вуглеводню складу С18Н38, - тверді речовини. Зі збільшенням числа атомів Карбону в молекулі зростають температури плавлення і кипіння алканів. Насичені вуглеводні нормальної (нерозгалуженої) будови мають вищі температури плавлення і кипіння порівняно з ізомерами. Практично не розчиняються у воді.
6. За стандартних умов алкани хімічно інертні, не взаємодіють з кислотами, лугами, окисниками (калій перманганат). Низька реакційна здатність пов’язана з високою енергією зв’язків С—С і С—Н.
І. Горіння: СН4 + 2О2 → СО2 + 2Н2О
ІІ. Реакції радикального заміщення:
-
Галогенування (за наявності hν; має ланцюговий механізм):
CH4 + Cl2 → CH3Cl + HCl
140ºC, p
-
Нітрування (реакція Коновалова): СН4 + HNO3 ——→ CH3−NO2 + H2O
ІІІ. Реакції крекінгу (при нагріванні – термічний, за навності каталізатору - каталітичний)
При крекінзі вищих алканів утворюється суміш алканів та алкенів; при розкладі метану утворюється ацетилен:
С8Н18 → С4Н10 + С4Н8; 2СН4 → С2Н2 + 3Н2
7. Основними джерелами алканів є природний газ, нафта і кам’яне вугілля.
Промислові: а) перегонка нафти
б) з синтез-газу: СО + 3Н2 → СН4 + Н2О
Лабораторні: а) гідрування ненасичених вуглеводнів:
CH3−CH=CH2 + H2 → CH3−CH2−CH3
б) реакція Вюрца: 2C2H5Br + 2Na → C2H5−C2H5 + 2NaBr
в) гідроліз карбіду алюмінію: Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
г) сплавлення солей карбонових кислот з лугами:
CH3COONa + NaOH → CH4 + Na2CO3
8. Метан. Оскільки внаслідок згоряння метану виділяється велика кількість теплоти, його використовують як відносно дешеве паливо у побуті та багатьох промислових процесах (доменному, скловарному). Продукт хімічної переробки метану – вуглець (у вигляді сажі) - використовують для виготовлення гуми, друкарської фарби; водень – для синтезу аміаку та гідрогенхлориду. Продукти неповного окиснення метану є вихідними речовинами для виготовлення пластмас, використовують їх і в органічному синтезі. З метану добувають ацетилен.
Пропан і бутан – гази, що легко скраплюються. Це зумовлює їх використання у побуті як палива. Ці алкани є сировиною для добування багатьох органічних речовин, з яких, у свою чергу, отримують інші сполуки.
Парафін використовують у медицині, виробництві мийних засобів, пластмас, свічок, жувальної гумки.
