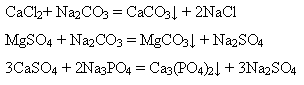- •Тема 1.1. Основні закони хімії
- •Закон збереження маси речовини
- •Контрольні запитання:
- •Тема 1.2. Оксиди
- •Визначення. Класифікація оксидів.
- •Контрольні запитання:
- •Тема 1.3. Основи
- •Визначення. Класифікація основ.
- •Контрольні запитання:
- •Тема 1.4. Кислоти
- •Визначення. Класифікація кислот.
- •Контрольні запитання:
- •Тема 1.5. Солі
- •Визначення. Класифікація солей.
- •Контрольні запитання:
- •Тема 1.6. Хімічний зв'язок
- •Поняття про хімічний зв'язок. Типи хімічного зв’язку.
- •Контрольні запитання:
- •Тема 1.7. Електролітична дисоціація. Реакції йонного обміну
- •Контрольні запитання:
- •Тема 1.8. Окисно-відновні реакції
- •Контрольні запитання:
- •Тема 2.1. Загальна характеристика металів
- •Контрольні запитання:
- •Тема 2.2. Корозія металів
- •Корозія металів. Види корозії.
- •Контрольні запитання:
- •Тема 2.3. Лужні метали
- •Контрольні запитання:
- •Тема 2.4. Кальцій
- •Кальцій.**
- •Контрольні запитання:
- •Тема 2.5. Сполуки Кальцію
- •Контрольні запитання:
- •Тема 2.6. Алюміній
- •Контрольні запитання:
- •Тема 2.7. Залізо
- •Контрольні запитання:
- •Тема 2.8. Сульфур. Сірка.
- •Контрольні запитання:
- •Тема 2.9. Сполуки Сульфуру
- •Контрольні запитання:
- •Тема 2.10. Сульфатна кислота та її солі
- •Контрольні запитання:
- •Тема 2.11. Нітроген. Азот.
- •Контрольні запитання:
- •Тема 2.12. Аміак. Солі амонію.
- •Контрольні запитання:
- •Тема 2.13. Сполуки Нітрогену
- •Контрольні запитання:
- •Тема 2. 14.Фосфор
- •Фосфор.
- •Контрольні запитання:
- •Тема 2.15. Сполуки Фосфору
- •Контрольні запитання:
- •Тема 2.16. Карбон. Вуглець.
- •Контрольні запитання:
- •Тема 2.16. Сполуки Карбону
- •Контрольні запитання:
- •Тема 2.18. Силіцій.
- •Контрольні запитання:
- •Тема 2.19. Сполуки Силіцію.
- •Контрольні запитання:
- •Тема 3.1. Теорія будови органічних речовин о.М. Бутлерова
- •Контрольні запитання:
- •Тема 3.2. Алкани
- •Контрольні запитання:
- •Тема 3.3. Алкени
- •Контрольні запитання:
- •Тема 3.4. Алкіни
- •Контрольні запитання:
- •Тема 3.5. Алкадієни (дієнові вуглеводні)
- •Контрольні запитання:
- •Тема 3.6. Ароматичні вуглеводні (арени)
- •Контрольні запитання:
- •Тема 3.7. Природні джерела вуглеводнів
- •Контрольні запитання:
- •Тема 4.1. Одноатомні спирти
- •Контрольні запитання:
- •Тема 4.2. Багатоатомні спирти
- •Контрольні запитання:
- •Тема 4.3. Феноли
- •Контрольні запитання:
- •Тема 4.4. Альдегіди
- •Контрольні запитання:
- •Тема 4.5. Карбонові кислоти
- •Контрольні запитання:
- •Тема 4.6. Естери
- •2. Номенклатура:
- •Контрольні запитання:
- •Тема 4.7. Жири. Мило
- •Контрольні запитання:
- •Тема 5.1. Вуглеводи. Глюкоза
- •Контрольні запитання:
- •Тема 5.2. Сахароза
- •Контрольні запитання:
- •Тема 5.3. Крохмаль і целюлоза
- •Контрольні запитання:
- •Тема 5.4. Аміни
- •Контрольні запитання:
- •Тема 5.5. Амінокислоти
- •Контрольні запитання:
- •Тема 5.6. Білки
- •Контрольні запитання:
Контрольні запитання:
-
Які метали називають лужноземельними? Чому?
-
Які фізичні властивості характерні для металів ІІ-А групи?
-
Назвіть природні сполуки Магнію і Кальцію.
-
Які хімічні властивості притаманні кальцію?
-
Способи добування кальцію.
-
Яке практичне значення металів ІІ-А групи.
-
Здійсніть перетворення за схемою, назвіть речовини:
CaCl2 → Ca→ Ca(OH)2→ CaCO3→ CaO→Ca(NO3)2
8. Яку масу кальцій оксиду можна отримати при прожарюванні вапняку масою 100 г, що містить 95% кальцій карбонату. Вихід продукту реакції складає 90% від теоретично можливого.
Література:
-
Данильченко В.Є., Фрадіна Н.В. Хімія. 8 – 9 класи: Навч. посібник. – Х.: Країна мрій™, 2003. - с. 164-165.
-
Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. ІІ, Гл. 13, §§ 105-106, с. 117-118.
-
Стахеєв О.Ю. Хімія. Узагальнюючі схеми і таблиці. – Тернопіль: «Богдан», 1998. – с. 19.
Тема 2.5. Сполуки Кальцію
План
-
Кальцій оксид.*
-
Кальцій гідроксид.*
-
Твердість води.**
1. Кальцій оксид (негашене вапно) СаО – кристалічна речовина білого кольору, дуже тугоплавка (tпл=2627oC).
Хімічні властивості. СаО - основний оксид:
1) бурхливо реагує з водою за стандартних умов: СаО + Н2О = Са(ОН)2
2) реагує з кислотами: CaO + 2HNO3 = Ca(NO3)2 + H2O
3) реагує з кислотними оксидами: CaO + SiO2 = CaSiO3
Добування: випалюванням вапняку за температури 900 – 1000оС
СаСО3 → СаО + СО2
Застосовується СаО як основа в’яжучих матеріалів, для добування хлорного вапна, соди і як флюс у доменному виробництві чавуну.
2. Кальцій гідроксид (гашене вапно) Са(ОН)2 – безбарвна кристалічна речовина, малорозчинна у воді, милка на дотик. Водний розчин називається вапняною водою, а суспензію – вапняним молоком.
За хімічними властивостями Са(ОН)2 - сильна основа, луг.
Добувають кальцій гідроксид за допомогою гасіння паленого (негашеного) вапна: СаО + Н2О = Са(ОН)2
Застосовують у будівництві як в’яжучий матеріал; у харчовій промисловості для знецукрювання патоки; у виробництві сталі як компонент шихти; для пом’якшення води; розкиснення грунтів; вапнування стовбурів дерев; добування солей Кальцію і натрій гідроксиду.
3. Природні води завжди містять хлориди, сульфати, гідрогенкарбонати Кальцію, Магнію та інші домішки.
Воду, що містить йони Са2+ і Mg2+, називають твердою, а воду, в якій немає йонів Са2+ і Mg2+ або їх зовсім мало, називають м’якою.
Сумарний вміст солей Кальцію та Магнію називається загальною твердістю. Загальна твердість води поділяється на карбонатну і некарбонатну.
Твердість води, що усувається кип’ятінням, називається тимчасовою твердістю. Карбонатна (тимчасова) твердість зумовлена наявністю гідрогенкарбонатів – Ca(HCO3)2 і Mg(HCO3)2.
Способи усунення карбонатної твердості:
1) кип’ятіння води:
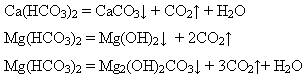
2) додавання вапняної води або гашеного вапна:
![]()
3) додавання натрій гідроксиду або соди:
![]()
Некарбонатна твердість зумовлена наявністю CaCl2, MgCl2, CaSO4, MgSO4. ЇЇ ще називають постійною твердістю, бо кип’ятінням вона не усувається. Зм’якшити воду з постійною твердістю можна тільки додаванням соди або натрій фосфату: