
- •Тема 1.1. Основні закони хімії
- •Закон збереження маси речовини
- •Контрольні запитання:
- •Тема 1.2. Оксиди
- •Визначення. Класифікація оксидів.
- •Контрольні запитання:
- •Тема 1.3. Основи
- •Визначення. Класифікація основ.
- •Контрольні запитання:
- •Тема 1.4. Кислоти
- •Визначення. Класифікація кислот.
- •Контрольні запитання:
- •Тема 1.5. Солі
- •Визначення. Класифікація солей.
- •Контрольні запитання:
- •Тема 1.6. Хімічний зв'язок
- •Поняття про хімічний зв'язок. Типи хімічного зв’язку.
- •Контрольні запитання:
- •Тема 1.7. Електролітична дисоціація. Реакції йонного обміну
- •Контрольні запитання:
- •Тема 1.8. Окисно-відновні реакції
- •Контрольні запитання:
- •Тема 2.1. Загальна характеристика металів
- •Контрольні запитання:
- •Тема 2.2. Корозія металів
- •Корозія металів. Види корозії.
- •Контрольні запитання:
- •Тема 2.3. Лужні метали
- •Контрольні запитання:
- •Тема 2.4. Кальцій
- •Кальцій.**
- •Контрольні запитання:
- •Тема 2.5. Сполуки Кальцію
- •Контрольні запитання:
- •Тема 2.6. Алюміній
- •Контрольні запитання:
- •Тема 2.7. Залізо
- •Контрольні запитання:
- •Тема 2.8. Сульфур. Сірка.
- •Контрольні запитання:
- •Тема 2.9. Сполуки Сульфуру
- •Контрольні запитання:
- •Тема 2.10. Сульфатна кислота та її солі
- •Контрольні запитання:
- •Тема 2.11. Нітроген. Азот.
- •Контрольні запитання:
- •Тема 2.12. Аміак. Солі амонію.
- •Контрольні запитання:
- •Тема 2.13. Сполуки Нітрогену
- •Контрольні запитання:
- •Тема 2. 14.Фосфор
- •Фосфор.
- •Контрольні запитання:
- •Тема 2.15. Сполуки Фосфору
- •Контрольні запитання:
- •Тема 2.16. Карбон. Вуглець.
- •Контрольні запитання:
- •Тема 2.16. Сполуки Карбону
- •Контрольні запитання:
- •Тема 2.18. Силіцій.
- •Контрольні запитання:
- •Тема 2.19. Сполуки Силіцію.
- •Контрольні запитання:
- •Тема 3.1. Теорія будови органічних речовин о.М. Бутлерова
- •Контрольні запитання:
- •Тема 3.2. Алкани
- •Контрольні запитання:
- •Тема 3.3. Алкени
- •Контрольні запитання:
- •Тема 3.4. Алкіни
- •Контрольні запитання:
- •Тема 3.5. Алкадієни (дієнові вуглеводні)
- •Контрольні запитання:
- •Тема 3.6. Ароматичні вуглеводні (арени)
- •Контрольні запитання:
- •Тема 3.7. Природні джерела вуглеводнів
- •Контрольні запитання:
- •Тема 4.1. Одноатомні спирти
- •Контрольні запитання:
- •Тема 4.2. Багатоатомні спирти
- •Контрольні запитання:
- •Тема 4.3. Феноли
- •Контрольні запитання:
- •Тема 4.4. Альдегіди
- •Контрольні запитання:
- •Тема 4.5. Карбонові кислоти
- •Контрольні запитання:
- •Тема 4.6. Естери
- •2. Номенклатура:
- •Контрольні запитання:
- •Тема 4.7. Жири. Мило
- •Контрольні запитання:
- •Тема 5.1. Вуглеводи. Глюкоза
- •Контрольні запитання:
- •Тема 5.2. Сахароза
- •Контрольні запитання:
- •Тема 5.3. Крохмаль і целюлоза
- •Контрольні запитання:
- •Тема 5.4. Аміни
- •Контрольні запитання:
- •Тема 5.5. Амінокислоти
- •Контрольні запитання:
- •Тема 5.6. Білки
- •Контрольні запитання:
Контрольні запитання:
-
Які оксиди утворює Карбон?
-
Порівняйте карбон (ІІ) і карбон (IV) оксиди.
-
Назвіть способи добування оксидів Карбону.
-
Де використовуються оксиди Карбону?
-
Яке практичне значення мають карбонати?
-
Яка сіль утвориться в результаті пропускання 2,24 л вуглекислого газу (н.у.) крізь 25 г розчину з масовою часткою натрій гідроксиду 16%?
Література:
-
Данильченко В.Є., Фрадіна Н.В. Хімія. 10 – 11 класи: Навч. посібник. – Х.: Країна мрій™, 2003. - с. 39-40.
-
Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. ІІ, Гл. 11, §§ 88-89, с. 103-104.
-
Стахеєв О.Ю. Хімія. Узагальнюючі схеми і таблиці. – Тернопіль.: «Богдан», 1998. – с. 32.
Тема 2.18. Силіцій.
План
-
Силіцій як хімічний елемент.
-
Будова та фізичні властивості силіцію.
-
Хімічні властивості.**
-
Добування.*
-
Застосування.
1.
Будова
атома:
![]()
Електронна конфігурація: 1s22s22p63s23p2
Можливі ступені окиснення Силіцію:
|
За поширенням у земній корі Силіцій посідає друге місце після Оксигену. Силіцій трапляється в природі лише у вигляді сполук, він – головний елемент неживої природи. Найпоширенішою сполукою Силіцію є кремнезем – силіцій (ІV) оксид. Більшість гірських порід (кварц, слюда, азбест, тальк, польовий шпат, пісок, глина, каолін, нефелін та ін.) утворені силікатами та алюмосилікатами:
![]()
Силіцій входить до складу стебел і листя рослин (особливо хвощу, бамбуку) і тваринних організмів (кістяк, сполучна тканина, пір’я птахів, шерсті тварин).
2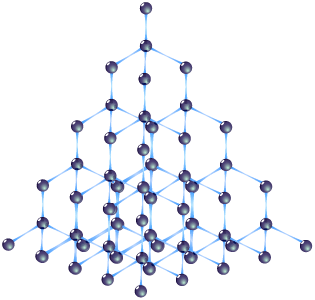 .
Силіцій – кристалічна
непрозора речовина, темно-сірого кольору
з металічним блиском, крихка, з
алмазоподібними кристалічними
гратками.
.
Силіцій – кристалічна
непрозора речовина, темно-сірого кольору
з металічним блиском, крихка, з
алмазоподібними кристалічними
гратками.
Атоми Силіцію, порівняно з атомами Карбону, мають більші радіуси, тому довжина зв’язків Si – Si в його кристалах більша за довжину зв’язків С – С, а їхня міцність – менша. Це зумовлює менші твердість і температуру плавлення (1415oC) кристалічного силіцію порівняно з алмазом. Силіцій – типовий напівпровідник.
3. За стандартних умов силіцій досить пасивний, він виявляє слабші неметалічні властивості, ніж вуглець:
1) під час сильного нагрівання горить на повітрі:
![]()
2) взаємодіє у розплавах з багатьма металами, виявляючи окисні властивості та утворюючи силіциди:
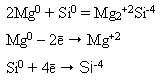
3) взаємодіє з оксидами металів, виявляючи відновні властивості:
![]()
4) взаємодіє з неметалами (за винятком фосфору):

4. Силіцій добувають внаслідок відновлення кремнезему магнієм, алюмінієм або вугіллям за високих температур в електропечах:
![]()
5. Силіцій застосовують:
1) як напівпровідних у електроніці для виготовлення інтегральних схем, діодів, транзисторів, сонячних батарей фотоприймачів, детекторів частинок у ядерній фізиці;
2) у металургії як відновник під час виробництва феросиліцію, є компонентом сталей, чавунів, бронз, силумінів;
3) для одержання кремнійорганічних сполук.
