
- •Тема 1.1. Основні закони хімії
- •Закон збереження маси речовини
- •Контрольні запитання:
- •Тема 1.2. Оксиди
- •Визначення. Класифікація оксидів.
- •Контрольні запитання:
- •Тема 1.3. Основи
- •Визначення. Класифікація основ.
- •Контрольні запитання:
- •Тема 1.4. Кислоти
- •Визначення. Класифікація кислот.
- •Контрольні запитання:
- •Тема 1.5. Солі
- •Визначення. Класифікація солей.
- •Контрольні запитання:
- •Тема 1.6. Хімічний зв'язок
- •Поняття про хімічний зв'язок. Типи хімічного зв’язку.
- •Контрольні запитання:
- •Тема 1.7. Електролітична дисоціація. Реакції йонного обміну
- •Контрольні запитання:
- •Тема 1.8. Окисно-відновні реакції
- •Контрольні запитання:
- •Тема 2.1. Загальна характеристика металів
- •Контрольні запитання:
- •Тема 2.2. Корозія металів
- •Корозія металів. Види корозії.
- •Контрольні запитання:
- •Тема 2.3. Лужні метали
- •Контрольні запитання:
- •Тема 2.4. Кальцій
- •Кальцій.**
- •Контрольні запитання:
- •Тема 2.5. Сполуки Кальцію
- •Контрольні запитання:
- •Тема 2.6. Алюміній
- •Контрольні запитання:
- •Тема 2.7. Залізо
- •Контрольні запитання:
- •Тема 2.8. Сульфур. Сірка.
- •Контрольні запитання:
- •Тема 2.9. Сполуки Сульфуру
- •Контрольні запитання:
- •Тема 2.10. Сульфатна кислота та її солі
- •Контрольні запитання:
- •Тема 2.11. Нітроген. Азот.
- •Контрольні запитання:
- •Тема 2.12. Аміак. Солі амонію.
- •Контрольні запитання:
- •Тема 2.13. Сполуки Нітрогену
- •Контрольні запитання:
- •Тема 2. 14.Фосфор
- •Фосфор.
- •Контрольні запитання:
- •Тема 2.15. Сполуки Фосфору
- •Контрольні запитання:
- •Тема 2.16. Карбон. Вуглець.
- •Контрольні запитання:
- •Тема 2.16. Сполуки Карбону
- •Контрольні запитання:
- •Тема 2.18. Силіцій.
- •Контрольні запитання:
- •Тема 2.19. Сполуки Силіцію.
- •Контрольні запитання:
- •Тема 3.1. Теорія будови органічних речовин о.М. Бутлерова
- •Контрольні запитання:
- •Тема 3.2. Алкани
- •Контрольні запитання:
- •Тема 3.3. Алкени
- •Контрольні запитання:
- •Тема 3.4. Алкіни
- •Контрольні запитання:
- •Тема 3.5. Алкадієни (дієнові вуглеводні)
- •Контрольні запитання:
- •Тема 3.6. Ароматичні вуглеводні (арени)
- •Контрольні запитання:
- •Тема 3.7. Природні джерела вуглеводнів
- •Контрольні запитання:
- •Тема 4.1. Одноатомні спирти
- •Контрольні запитання:
- •Тема 4.2. Багатоатомні спирти
- •Контрольні запитання:
- •Тема 4.3. Феноли
- •Контрольні запитання:
- •Тема 4.4. Альдегіди
- •Контрольні запитання:
- •Тема 4.5. Карбонові кислоти
- •Контрольні запитання:
- •Тема 4.6. Естери
- •2. Номенклатура:
- •Контрольні запитання:
- •Тема 4.7. Жири. Мило
- •Контрольні запитання:
- •Тема 5.1. Вуглеводи. Глюкоза
- •Контрольні запитання:
- •Тема 5.2. Сахароза
- •Контрольні запитання:
- •Тема 5.3. Крохмаль і целюлоза
- •Контрольні запитання:
- •Тема 5.4. Аміни
- •Контрольні запитання:
- •Тема 5.5. Амінокислоти
- •Контрольні запитання:
- •Тема 5.6. Білки
- •Контрольні запитання:
Контрольні запитання:
-
Які вам відомі природні джерела вуглеводнів?
-
Які гази називають природними, супутніми?
-
На чому рунтується переробка нафти? Назвіть головні продукти її переробки.
-
Що називається крекінгом?
-
Назвіть головні продукти переробки кам’яного вугілля.
Література:
-
Данильченко В.Є., Фрадіна Н.В. Хімія. 10 – 11 класи: Навч. посібник. – Х.: Країна мрій™, 2003. - с. 88-91.
-
Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. ІІІ, Гл. 16, §§ 140-141, с. 144-146.
-
Березан О.В. Органічна хімія. – К.: Абрис, 2000. – Р. ІІІ, § 9, с. 74-75.
РОЗДІЛ 4. Оксигеновмісні органічні речовини
Тема 4.1. Одноатомні спирти
План
-
Визначення та загальна формула класу.
-
Будова.
-
Номенклатура.*
-
Ізомерія.*
-
Фізичні властивості.
-
Хімічні властивості.**
-
Добування.*
-
Застосування.
1. Спирти можна розглядати як похідні вуглеводнів, у яких атом Гідрогену заміщений на гідроксильну групу –ОН.
Залежно від будови вуглеводневого радикалу розрізняють насичені, ненасичені, ароматичні спирти, а за кількістю гідроксильних груп – одно- і багатоатомні.
Загальна формула насичених одноатомних спиртів СnH2n+1OH або СnH2n+2O.
2. Зв'язок О—Н поляризований, оскільки атом більш електронегативного атома Оксигену відтягує до себе електронну густину зв'язку. Внаслідок поляризації на атомі Гідрогену утворюється частковий позитивний, а на атомі Оксигену – частковий негативний заряд:
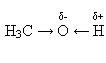
3. Нумерація ланцюга здійснюється з того боку, куди ближче гідроксогрупа. До назви відповідного алкану додається суфікс –ол. Після назви цифрою зазначається місце гідроксогрупи.
4. Структурна ізомерія: а) карбонового скелета
бутанол-1 2-метилпропанол-1
СН3−СН2−СН2−СН2ОН СН3 −СН−СН2ОН
|
СН3
б) положення функціональної групи
бутанол-1 бутанол-2
СН3−СН2−СН2−СН2ОН СН3 −СН2−СНОН −СН3
Ізомерія з етерами:
СН3−О−СН3 СН3−СН2ОН
Диметиловий етер етанол
5. Спирти, які містять в молекулі до 15 атомів Карбону є рідинами, більше 15 – твердими речовинами. Нижчі спирти нерозчинні у воді, вищі практично нерозчинні. Серед спиртів, на відміну від вуглеводнів, немає газуватих речовин. Температури плавлення і кипіння спиртів значно вищі порівняно з вуглеводнями з такою самою відносною молекулярною масою
6. Хімічні властивості спиртів:
І. Горіння: С2Н5ОН +3О2 → 2СО2 + 3Н2О
ІІ. Взаємодіють з активними металами, утворюючи алкоголяти:
2C2H5OH + 2Na → 2C2H5ONa + H2
ІІІ. Реакції естерифікації – реакція взаємодії кислот з спиртами:
СН3СООН +НОСН3 → СН3СООСН3 + Н2О
ІV. Гідрогалогенування: C2H5OH + HBr → C2H5Br + H2O
V. Окиснення (CuO, KMnO4):
А) первинний спирт → альдегіди: C2H5OH + СuO → CH3−C=O + Cu + H2O
|
H
Б) вторинний спирт → кетони: CH3−C−CH3 + СuO → CH3−C−CH3 + Cu + H2O
| ||
OH O
В) третинний спирт → практично не окислюються
VІ. Дегідратація – процес відщеплення молекули води:
А) внутрішньомолекулярна з утворенням алкенів
Правило Зайцева: Гідроген відщеплюється від менш гідрогенізованого атома Карбону
C2H5OH → CH2= CH2 + H2O
Б) міжмолекулярна з утворенням етерів:
C2H5OH + C2H5OH → C2H5−O−C2H5 + Н2О
В) Реакція Лебедєва:
2C2H5OH → CH2=CH−CH=CH2 + 2H2O + H2
бутадієн-1,3
-
Загальні методи добування:
OH–
-
гідроліз галогенпохідних вуглеводнів: R–CH2–Cl + H2O → R–CH2–OH + HCl
-
відновлення альдегідів: R–C=O + H2 → R–CH2–OH
|
H
Методи добування метанолу: 1) суха перегонка
2) з синтез-газу: СО + 2Н2 → СН3–ОН
Методи добування етанолу:
1) спиртове бродіння глюкози: С6Н12О6 → 2С2Н5ОН + 2СО2
2) гідратація етилену: СН2=СН2 + Н2О → СН3–СН2–ОН
8. Метанол: у промисловому органічному синтезі; як розчинник; як додаток до бензину.
Етанол: для виробництва оцтової кислоти та бутадієну-1,3; як розчинник; у парфумах; у медицині; як паливо; у харчовій промисловості.
