
- •Тема 1.1. Основні закони хімії
- •Закон збереження маси речовини
- •Контрольні запитання:
- •Тема 1.2. Оксиди
- •Визначення. Класифікація оксидів.
- •Контрольні запитання:
- •Тема 1.3. Основи
- •Визначення. Класифікація основ.
- •Контрольні запитання:
- •Тема 1.4. Кислоти
- •Визначення. Класифікація кислот.
- •Контрольні запитання:
- •Тема 1.5. Солі
- •Визначення. Класифікація солей.
- •Контрольні запитання:
- •Тема 1.6. Хімічний зв'язок
- •Поняття про хімічний зв'язок. Типи хімічного зв’язку.
- •Контрольні запитання:
- •Тема 1.7. Електролітична дисоціація. Реакції йонного обміну
- •Контрольні запитання:
- •Тема 1.8. Окисно-відновні реакції
- •Контрольні запитання:
- •Тема 2.1. Загальна характеристика металів
- •Контрольні запитання:
- •Тема 2.2. Корозія металів
- •Корозія металів. Види корозії.
- •Контрольні запитання:
- •Тема 2.3. Лужні метали
- •Контрольні запитання:
- •Тема 2.4. Кальцій
- •Кальцій.**
- •Контрольні запитання:
- •Тема 2.5. Сполуки Кальцію
- •Контрольні запитання:
- •Тема 2.6. Алюміній
- •Контрольні запитання:
- •Тема 2.7. Залізо
- •Контрольні запитання:
- •Тема 2.8. Сульфур. Сірка.
- •Контрольні запитання:
- •Тема 2.9. Сполуки Сульфуру
- •Контрольні запитання:
- •Тема 2.10. Сульфатна кислота та її солі
- •Контрольні запитання:
- •Тема 2.11. Нітроген. Азот.
- •Контрольні запитання:
- •Тема 2.12. Аміак. Солі амонію.
- •Контрольні запитання:
- •Тема 2.13. Сполуки Нітрогену
- •Контрольні запитання:
- •Тема 2. 14.Фосфор
- •Фосфор.
- •Контрольні запитання:
- •Тема 2.15. Сполуки Фосфору
- •Контрольні запитання:
- •Тема 2.16. Карбон. Вуглець.
- •Контрольні запитання:
- •Тема 2.16. Сполуки Карбону
- •Контрольні запитання:
- •Тема 2.18. Силіцій.
- •Контрольні запитання:
- •Тема 2.19. Сполуки Силіцію.
- •Контрольні запитання:
- •Тема 3.1. Теорія будови органічних речовин о.М. Бутлерова
- •Контрольні запитання:
- •Тема 3.2. Алкани
- •Контрольні запитання:
- •Тема 3.3. Алкени
- •Контрольні запитання:
- •Тема 3.4. Алкіни
- •Контрольні запитання:
- •Тема 3.5. Алкадієни (дієнові вуглеводні)
- •Контрольні запитання:
- •Тема 3.6. Ароматичні вуглеводні (арени)
- •Контрольні запитання:
- •Тема 3.7. Природні джерела вуглеводнів
- •Контрольні запитання:
- •Тема 4.1. Одноатомні спирти
- •Контрольні запитання:
- •Тема 4.2. Багатоатомні спирти
- •Контрольні запитання:
- •Тема 4.3. Феноли
- •Контрольні запитання:
- •Тема 4.4. Альдегіди
- •Контрольні запитання:
- •Тема 4.5. Карбонові кислоти
- •Контрольні запитання:
- •Тема 4.6. Естери
- •2. Номенклатура:
- •Контрольні запитання:
- •Тема 4.7. Жири. Мило
- •Контрольні запитання:
- •Тема 5.1. Вуглеводи. Глюкоза
- •Контрольні запитання:
- •Тема 5.2. Сахароза
- •Контрольні запитання:
- •Тема 5.3. Крохмаль і целюлоза
- •Контрольні запитання:
- •Тема 5.4. Аміни
- •Контрольні запитання:
- •Тема 5.5. Амінокислоти
- •Контрольні запитання:
- •Тема 5.6. Білки
- •Контрольні запитання:
Контрольні запитання:
-
Яке місце в періодичній системі елементів займає Карбон?
-
Наведіть електронну формулу атома Карбону. Які ступені окиснення для нього характерні?
-
Що таке алотропія? Пояснити на прикладі Карбону.
-
Охарактеризуйте хімічні властивості вуглецю.
-
Де використовуються алотропні модифікації Карбону?
-
Обчисліть масу карбон(IV) оксиду, який можна добути при взаємодії кальцій карбонату масою 7 г з розчином хлоридної кислоти масою 30 г, де масова частка HCl складає 20%.
Література:
-
Данильченко В.Є., Фрадіна Н.В. Хімія. 10 – 11 класи: Навч. посібник. – Х.: Країна мрій™, 2003. - с. 37-38.
-
Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. ІІ, Гл. 11, §§ 86-87, с. 101-103.
-
Стахеєв О.Ю. Хімія. Узагальнюючі схеми і таблиці. – Тернопіль.: «Богдан», 1998. – с. 32.
Тема 2.16. Сполуки Карбону
План
-
Карбон (ІІ) оксид.**
-
Карбон (ІV) оксид.**
-
Карбонатна кислота та її солі.**
1. Карбон утворює два оксиди СO і СO2.
Карбон (ІІ) оксид (чадний газ) – безбарвний газ, без запаху, погано розчиняється у воді, трохи легший за повітря, отруйний.
Карбон (ІІ) оксид – несолетворний оксид. За стандартних умов не взаємодіє з водою, кислотами, лугами. Йому притаманні такі властивості:
-
здатність горіти васильково синім полум’ям, виділяючи велику кількість теплоти:
![]()
-
здатність відновлювати метали з оксидів:
![]()
-
взаємодіє з хлором з утворенням фосгену – отруйної речовини, що належить до хімічної зброї:

Добування: У лабораторії карбон (ІІ) оксид добувають з метанової кислоти під дією концентрованої сульфатної кислоти, яка відбирає воду:
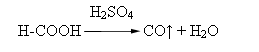
У промисловості його добувають різними способами:
-
внаслідок взаємодії карбон (IV) оксиду з розжареним вугіллям за температури понад 450ºC в умовах нестачі повітря:
CO2 + C = 2CO
-
дією водяної пари на розпечене вугілля:

Застосування:
-
для відновлення металів з їх оксидів;
-
в органічному синтезі (для добування спиртів, вуглеводів, альдегідів, карбонових кислот);
-
як висококалорійне паливо.
2. Карбон (ІV) оксид (вуглекислий газ).
![]()
Молекула має лінійну будову, хімічний зв’язок ковалентний полярний, але диполь не виникає, оскільки молекула симетрична. Кристалічні гратки – молекулярні.
Фізичні властивості: безбарвний газ, без запаху, важчий за повітря у 1,5 рази, доволі добре розчиняється у воді, особливо під тиском, легко зріджується навіть за кімнатної температури і невеликого тиску (5 МПа). Зріджений карбон (ІV) оксид зберігають у стальних балонах. Якщо його швидко вилити з балона, вуглекислий газ випаровується, внаслідок чого частина газу перетворюється на снігоподібну масу – сухий лід.
Хімічні властвисоті: СО2 – кислотний оксид:
1) Він взаємодіє з водою, утворюючи нестійку карбонатну кислоту:
![]()
2) взаємодіє з основами і основними оксидами, як у водних розчинах, так і з твердими, утворюючи солі – карбонати:

Добування: У лабораторії вуглекислий газ добувають дією хлоридної кислоти на мармур:
![]()
У промисловості – прожарюванням вапняку:
![]()
Застосування:
-
для виробництва соди;
-
для гасіння пожеж (содові вогнегасники);
-
для газування напоїв;
-
для виготовлення сухого льоду для зберігання продуктів, які швидко псуються.
3. Карбонатна кислота – нестійка сполука, існує лише у водному розчині:
![]()
Це – слабка двохосновна кислота, у водному розчині дисоціює на йони (ступінчасто):
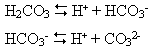
Карбонатна кислота утворює два ряди солей: середні – карбонати і кислі – гідрогенкарбонати. Карбонати лужних і лужноземельних металів та амонію і всі гідрогенкарбонати розчиняються у воді. Карбонати інших металів у воді не розчиняються, а карбонати Алюмінію, Хрому (ІІІ), Феруму (ІІІ), Купруму (ІІ) не існують.
Хімічні властивості:
1) Під впливом сильних кислот на солі карбонатної кислоти виділяється карбон(IV) оксид:
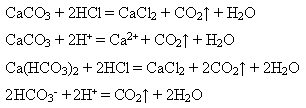
2) Усі карбонати, крім солей лужних металів, внаслідок нагрівання розкладаються:
![]()
3) Карбонати перетворюються на гідрогенкарбонати під впливом водного розчину, що містить вуглекислий газ:
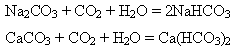
4) Гідрогенкарбонати лужних металів перетворюються на карбонати під час нагрівання:
![]()
Застосування карбонатів.
|
