
- •Тема 1.1. Основні закони хімії
- •Закон збереження маси речовини
- •Контрольні запитання:
- •Тема 1.2. Оксиди
- •Визначення. Класифікація оксидів.
- •Контрольні запитання:
- •Тема 1.3. Основи
- •Визначення. Класифікація основ.
- •Контрольні запитання:
- •Тема 1.4. Кислоти
- •Визначення. Класифікація кислот.
- •Контрольні запитання:
- •Тема 1.5. Солі
- •Визначення. Класифікація солей.
- •Контрольні запитання:
- •Тема 1.6. Хімічний зв'язок
- •Поняття про хімічний зв'язок. Типи хімічного зв’язку.
- •Контрольні запитання:
- •Тема 1.7. Електролітична дисоціація. Реакції йонного обміну
- •Контрольні запитання:
- •Тема 1.8. Окисно-відновні реакції
- •Контрольні запитання:
- •Тема 2.1. Загальна характеристика металів
- •Контрольні запитання:
- •Тема 2.2. Корозія металів
- •Корозія металів. Види корозії.
- •Контрольні запитання:
- •Тема 2.3. Лужні метали
- •Контрольні запитання:
- •Тема 2.4. Кальцій
- •Кальцій.**
- •Контрольні запитання:
- •Тема 2.5. Сполуки Кальцію
- •Контрольні запитання:
- •Тема 2.6. Алюміній
- •Контрольні запитання:
- •Тема 2.7. Залізо
- •Контрольні запитання:
- •Тема 2.8. Сульфур. Сірка.
- •Контрольні запитання:
- •Тема 2.9. Сполуки Сульфуру
- •Контрольні запитання:
- •Тема 2.10. Сульфатна кислота та її солі
- •Контрольні запитання:
- •Тема 2.11. Нітроген. Азот.
- •Контрольні запитання:
- •Тема 2.12. Аміак. Солі амонію.
- •Контрольні запитання:
- •Тема 2.13. Сполуки Нітрогену
- •Контрольні запитання:
- •Тема 2. 14.Фосфор
- •Фосфор.
- •Контрольні запитання:
- •Тема 2.15. Сполуки Фосфору
- •Контрольні запитання:
- •Тема 2.16. Карбон. Вуглець.
- •Контрольні запитання:
- •Тема 2.16. Сполуки Карбону
- •Контрольні запитання:
- •Тема 2.18. Силіцій.
- •Контрольні запитання:
- •Тема 2.19. Сполуки Силіцію.
- •Контрольні запитання:
- •Тема 3.1. Теорія будови органічних речовин о.М. Бутлерова
- •Контрольні запитання:
- •Тема 3.2. Алкани
- •Контрольні запитання:
- •Тема 3.3. Алкени
- •Контрольні запитання:
- •Тема 3.4. Алкіни
- •Контрольні запитання:
- •Тема 3.5. Алкадієни (дієнові вуглеводні)
- •Контрольні запитання:
- •Тема 3.6. Ароматичні вуглеводні (арени)
- •Контрольні запитання:
- •Тема 3.7. Природні джерела вуглеводнів
- •Контрольні запитання:
- •Тема 4.1. Одноатомні спирти
- •Контрольні запитання:
- •Тема 4.2. Багатоатомні спирти
- •Контрольні запитання:
- •Тема 4.3. Феноли
- •Контрольні запитання:
- •Тема 4.4. Альдегіди
- •Контрольні запитання:
- •Тема 4.5. Карбонові кислоти
- •Контрольні запитання:
- •Тема 4.6. Естери
- •2. Номенклатура:
- •Контрольні запитання:
- •Тема 4.7. Жири. Мило
- •Контрольні запитання:
- •Тема 5.1. Вуглеводи. Глюкоза
- •Контрольні запитання:
- •Тема 5.2. Сахароза
- •Контрольні запитання:
- •Тема 5.3. Крохмаль і целюлоза
- •Контрольні запитання:
- •Тема 5.4. Аміни
- •Контрольні запитання:
- •Тема 5.5. Амінокислоти
- •Контрольні запитання:
- •Тема 5.6. Білки
- •Контрольні запитання:
Контрольні запитання:
-
Які речовини називають вуглеводнями?
-
Які вуглеводні називають насиченими? Загальна формула алканів.
-
Які речовини називають гомологами? Наведіть приклади.
-
Які речовини називають ізомерами? Наведіть приклади.
-
Які типи хімічних реакцій притаманні насиченим вуглеводням?
-
Який об’єм кисню необхідний для спалювання 3,36 л метану?
-
Який об’єм вуглекислого газу утвориться при спалюванні природного газу об’ємом 20 л, якщо об’ємна частка метану в ньому становить 95%?
Література:
-
Данильченко В.Є., Фрадіна Н.В. Хімія. 10 – 11 класи: Навч. посібник. – Х.: Країна мрій™, 2003. - с. 49-53.
-
Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. ІІІ, Гл. 16, §§ 130-131, с. 134-137.
-
Стахеєв О.Ю. Хімія. Узагальнюючі схеми і таблиці. – Тернопіль.: «Богдан», 1998. – с. 34.
-
Березан О.В. Органічна хімія. – К.: Абрис, 2000. – Р. І, §§ 2-5, с. 8-12.
Тема 3.3. Алкени
План
-
Визначення та загальна формула класу.
-
Будова.
-
Номенклатура.*
-
Ізомерія.*
-
Фізичні властивості.
-
Хімічні властивості.**
-
Одержання.*
-
Застосування.
1. Ненасичені вуглеводні – вуглеводні, в яких атоми Карбону сполучені між собою за допомогою кратних (подвійних або потрійних) зв'язків. Вуглеводні з одним подвійним зв'язком у молекулі належать до етиленових вуглеводнів (алкенів), за назвою найпростішого – етилену С2Н4
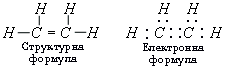
Загальна формула алкенів СnН2n.
2. Для алкенів характерна sp2-гібридизація. Між атомами Карбону в молекулі етилену утворюється подвійний з'язок: один σ-, другий - π-зв'язок. Довжина подвійного зв’язку – 0,134 нм, валентні кути – 120о, енергія зв'язку – 614 кДж/моль.
π -зв’язок менш міцний, оскільки його електронна густина зосереджена не між атомними ядрами, а вище і нижче від них.
3. Нумерація ланцюга здійснюється з того боку, куди ближче подвійний зв’язок. В назвах відповідного алкану суфікс –ан замінюється на –ен. Після назви цифрою зазначається місце кратного зв’язку.
1 2 3 4
СН3−СН=СН−СН3 бутен-2
4. Структурна ізомерія: а) карбонового скелета
бутен-1 метилпропен
СН2=СН−СН2−СН3 СН2=С−СН3
|
СН3
б) положення кратного зв’язку
бутен-1 бутен-2
СН2=СН−СН2−СН3 СН3−СН=СН−СН3
Просторова ізомерія (цис-, транс- ізомерія) для алкенів симетричної будови: коли два вуглеводневих радикали розміщуються з одного (цис-ізомер) або з різних (транс-ізомер) боків від подвійного зв’язку.
5. Алкени за нормальних умов С2-С4 – гази, С5-С17 – рідини, далі – тверді речовини. Нерозчинні у воді , але розчиняються в неполярних органічних розчинниках. Так само, як у алканів, їхні температури плавлення і кипіння підвищуються зі збільшенням довжини карбонового ланцюга. Алкени з розгалуженою будовою молекул мають нижчі температури плавлення порівняно зі сполуками з нормальною будовою молекул.
6. Хімічна активність алкенів зумовлена наявністю в молекулах подвійного зв'язку.
І. Горіння: С2Н4 +3О2 → 2СО2 + 2Н2О
ІІ. Реакції приєднання:
-
Гідрування (за наявності каталізатору): CH2= CH2 + Н2 → CH3− CH3
-
Галогенування: CH2= CH2 + Br2 → CH2Br− CH2Br
Знебарвлення бромної або йодної води – якісна реакція на наявність кратного зв’язку.
-
Гідрогалогенування: CH2= CH2 + НCl → CH2Cl− CH3
Правило Марковникова: у разі приєднання гідрогенгалогенідів до несиметричних алкенів за місцем подвійного зв'язку атом Гідрогену приєднується до того атома Карбону, який сполучений з більшим числом атомів Гідрогену.
CH3− CH= CH2 + НCl → CH3−CHCl− CH3
-
Гідратації: CH2= CH2 + Н2О → CH3− CH2ОН
ІІІ. Реакції полімеризації – реакції послідовного сполучення молекул низькомолекулярної речовини з утворенням високомолекулярної.
nCH2= CH2 → (−CH2− CH2 −)n
поліетилен
ІV. Окиснення – реакція Вагнера (знебарвлення водного розчину калій перманганату):
3СH2=CH2 + 2KMnO4 + 4H2O → 3CH2-CH2 + 2MnO2 + 2KOH
| |
OH OH
етиленгліколь
7. Промислові: а) крекінг нафтопродуктів
б) дегідрування насичених вуглеводнів: С3Н8 → С2Н6 + Н2
в) з галогенпохідних насичених вуглеводнів:
СH3−CH2−Cl + KOH(спирт.) → CH2=CH2 + KCl + H2O
Лабораторні: а) гідрування алкінів: CH≡CH + H2 → CH2=CH2
t, H+
б) дегідратація спиртів: CH3− CH2ОН → CH2= CH2 + Н2О
8. З етиленових вуглеводнів добувають багато різних продуктів, насамперед поліетилен і поліпропілен, які використовують для виробництва пластмас; дихлоретану, етанолу.
