
Lektsii_Fizika_chast_II
.pdf
чину dV S*dx, при этом ни сила F, с которой газ действует на поршень, ни само давление p F/S* не успевают измениться. С учётом того, что в данном случае угол 0, совершаемую газом работу A можно вычислить, как
|
|
A ( F |
dr ) Fdx cos Fdx |
Итак, расширяясь, газ совершает работу
|
A pdV, |
|
2 |
или |
A pdV . |
|
1 |
F S*dx pdV.
S *
(16.4)
(16.5)
Рассмотрим примеры.
- Изохорный процесс: V const, dV 0, следовательно, A 0,
то есть в ходе такого процесса работа газом не совершается.
|
2 |
2 |
- |
Изобарный процесс: p const, A pdV p dV p(V2 V1), |
|
|
1 |
1 |
или |
A p V |
(16.6) |
- Изотермический процесс: T const. В ходе вычислений ис-
пользуем уравнение Клапейрона – Менделеева, из которого сле-
дует, что p |
Μ |
|
RT |
, то есть |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||||
|
V |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2 |
2 |
Μ |
|
Μ |
2 |
dV |
|
Μ |
|
V2 |
|
|||
A pdV |
|
RTdV |
RT |
|
RT ln |
. (16.7) |
||||||||
1 |
1 |
V |
|
|
1 |
V |
|
|
|
V |
|
|||
|
|
|
|
|
|
|
1 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- Для расчёта работы, совершаемой газом в ходе процесса, при котором меняются все его параметры, удобно использовать график этого процесса, построенный в координатах давление – объём (p V). Используя формулу (16.5), а также вспомнив, каков графический смысл определённого интеграла, общую работу, совершаемую газом при расширении от V1 до V2, можно рассчитать, как площадь под кривой на графике (при этом по оси абсцисс
150
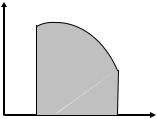
p, Па |
1 |
|
должны быть отложены кубиче- |
|
ские метры, а по оси ординат – |
||
|
|
|
|
|
|
|
паскали) – см. рис. 16.3. |
|
2 |
2 |
Приведённые примеры показы- |
|
A pdV |
||
|
|
вают: работа, совершаемая газом |
|
|
1 |
|
при переходе из состояния 1 в со- |
|
|
|
|
0 |
|
V, м3 |
стояние 2, зависит от того, каким |
|
образом совершается этот процесс. |
||
|
|
|
|
|
Рис. 16.3 |
|
Это означает: работа A в отличие |
от внутренней энергии U функцией состояния не является.
Примечание 2
Используя зависимости (16.1) – (16.7), формулу первого начала термодинамики в случае идеального газа постоянной массы (неизменного числа частиц) можно записать следующим образом:
- |
в общем случае: |
Q |
|
i |
M |
|
|
RdT pdV; |
||||||||
2 |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
- |
в изохорном процессе: |
Q |
|
i |
M |
|
RdT; |
|||||||||
|
2 |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
- |
в изобарном процессе: |
Q |
i |
|
|
M |
|
|
R T p V; |
|||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|||
- |
в изотермическом процессе: |
Q pdV |
|
Μ |
RT ln |
V2 |
; |
|||||||||
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
- в адиабатном процессе (происходящем без теплообмена с окружающей средой, то есть при Q 0) формула первого нача-
ла термодинамики записывается так: |
0 |
i |
|
M |
RdT pdV. |
|
|
|
|||
|
2 |
|
|
||
Примечание 3
Поскольку внутренняя энергия идеального газа определяется лишь его температурой и не зависит от объёма, при расширении такого газа в пустоту его температура не меняется: процесс оказывается изотермическим.
151
В случае реального газа его адиабатное расширение сопровождается увеличением среднего расстояния между молекулами, которые взаимодействуют друг с другом. Совершается работа против сил притяжения, внутренняя энергия и температура газа понижаются.
Явление изменения температуры реального газа при его адиабатном расширении от одного постоянного давления к другому называется эффектом Джоуля-Томсона.
16.2 Теплоёмкость
Выше мы отметили, что работа, совершаемая идеальным газом при переходе из одного состояния в другое, зависит от того, каким образом происходит переход. Очевидно, этот же вывод можно сделать и в отношения количества теплоты Q, требуемой для такого перехода. Для описания подобных процессов в теплофизике введено понятие теплоёмкости, которое может иметь несколько вариантов.
- Теплоёмкость тела cтела числено равна количеству теплоты, которое необходимо сообщит телу, чтобы нагреть его на 1 К:
cтела Q . |
(16.8) |
dT |
|
|
|
- Удельная теплоёмкость cуд численно равна |
количеству |
теплоты, которое необходимо сообщить одному килограмму вещества с тем, чтобы нагреть его на 1 К:
суд |
|
1 |
|
Q . |
(16.9) |
|
|
|
|||
|
M dT |
|
|||
- Молярная теплоёмкость |
С |
численно равна |
количеству |
||
теплоты, которое необходимо сообщить одному молю вещества с тем, чтобы нагреть его на 1 К:
C |
1 |
Q |
|
Q . |
(16.10) |
|
|
||||
|
dT |
M dT |
|
||
|
|
|
|
|
|
152

В случае идеального газа на практике чаще всего используется именно молярная теплоёмкость, однако численное значение C определяется тем, как происходит передача тепла.
a) Молярная теплоёмкость СV в изохорном процессе:
СV |
Q |
|
|
1 |
|
i M |
RdT, или |
||||
|
|
|
|
|
|
|
|
|
|||
M dT |
M dT |
|
2 |
||||||||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СV |
i |
R. |
|
|
|
|
(16.11) |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
2 |
|
|
|
|
|
|
|
b) Молярная теплоёмкость СP в изобарном процессе:
СP |
|
Q |
1 |
( |
i |
|
M |
RdT pdV) СV |
|
|
1 |
pdV. |
||
|
|
|
|
|
|
|
||||||||
|
M dT |
M dT |
2 |
|
|
|
M dT |
|||||||
Но, согласно уравнению Клапейрона – Менделеева, pV Μ RT,
и, взяв дифференциал от обеих частей уравнения с учётом того,
что в изобарном процессе p const, получим: pdV Μ RdT.
В результате формула для СP приобретает вид, который назы-
вается уравнением Майера:
СP СV R. |
(16.12) |
|
|
Молярную теплоёмкость идеального газа при постоянном давлении (так же, как это мы уже сделали в случае СV) можно выразить через число степеней свободы i молекул этого газа:
СP |
i 2 |
R. |
(16.13) |
|
|||
2 |
|
|
|
Примечание 4
(О единицах измерения теплоты и теплоёмкости)
В СИ единицей измерения теплоты, энергии и работы является джоуль. Однако в теплотехнике часто используются ещё одна, внесистемная единица измерения: калория. Одна калория равна
153

количеству теплоты, необходимому для нагрева 1 г воды на 1 К
(или на 1 ºС от 14,5 ºС до 15,5 ºС); 1 кал 4,18 Дж.
[cтела] Дж К 1;
[cуд] Дж кг 1 К 1; [C] Дж моль 1 К 1.
16.3Адиабатный процесс
Вадиабатном (адиабатическом) процессе Q 0, а это означает, что 0 dU A, то есть при совершении газом работы его
внутренняя |
энергия уменьшается: A |
dU |
или pdV |
|
|||||||
|
i |
M |
RdT. |
Но из уравнения Клапейрона – |
Менделеева следует: |
||||||
|
|
|
|
|
|||||||
2 |
|
|
|
|
|
|
|
|
|
||
|
M |
|
RdT |
d(pV). Это позволяет записать: |
pdV |
|
i |
d(pV) |
|
||
|
|
|
|
||||||||
|
|
|
|
|
|
2 |
|
|
|||
i (pdV Vdp). Разделяя переменные, получаем дифференциаль-
2
ное уравнение вида
i 2 dV |
|
i |
|
dp |
. |
|||
|
|
|
|
|
|
|||
2 V |
||||||||
2 |
|
p |
||||||
Если в начале адиабатного процесса газ имел объём V1 при давлении p1, а в конце – объём V2 при давлении p2, можно записать:
|
|
V |
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i 2 |
2 |
dV |
|
i |
2 |
dp |
|
, |
|
или |
i 2 |
ln |
V2 |
ln |
p2 |
. |
(16.14) |
||||||||||||||||||
|
2 |
V1 |
V |
|
|
2 |
p1 |
|
p |
|
|
|
|
|
|
|
|
i |
|
|
|
|
V1 |
|
|
|
p1 |
|
|
|
|
|||||
Заметим: СV |
|
i |
|
R; |
|
СP |
i 2 |
R, следовательно, |
i 2 |
|
|
CP |
. |
|||||||||||||||||||||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
CV |
||||||
Введём обозначение: |
|
CP |
, тогда формула (16.14) приобре- |
|||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CV |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
V |
|
|
|
|
|
|
p |
|
|
|
|
|
|
V |
|
|
|
|
p |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
тает вид: ln |
|
2 |
ln |
|
|
2 |
, откуда |
|
2 |
|
|
|
|
|
|
1 |
, или p1V1 p2V2 . |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
V1 |
|
|
|
|
|
|
p1 |
|
|
|
|
V1 |
|
|
|
|
|
p2 |
|
|
|
|||||||||||
154
Другими словами, в ходе адиабатного процесса произведение вида pV остается постоянным. Данное условие, записанное в виде
pV const, |
(16.15) |
где CP , называется уравнением Пуассона для адиабатного
CV
процесса.
Примечание 5
Поскольку речь идёт об идеальном газе, для которого справедливо уравнение Клапейрона – Менделеева, от переменных p и V в уравнении (16.15) можно перейти к переменным V и T или p и T. Так, например, в случае переменных p и T уравнение Пуассона
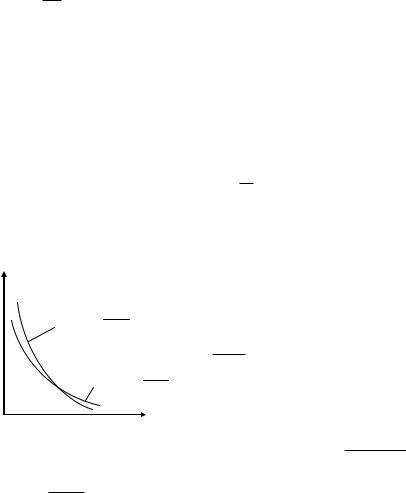
записывается следующим образом: р T const.
Примечание 6
p
адиабата, p const
V
изотерма, p const
V
0 |
V |
Рис. 16.4
Построим график адиабатного процесса в координатах p V.
Из уравнения (16.15) следует, что в адиабатном процессе
const
p , то есть графиком про-
V
цесса будет являться гипербола (чем V больше, тем p меньше). Сходный вид в этих же координа-
тах имеет изотерма (p (M / R V
или p const ), однако адиабата спадает круче, так как показа-
V
155
тель степени |
i 2 |
1. Например, для одноатомного газа i 3, |
|
i |
|||
|
|
5/3 1,7; для двухатомного i 5, 7/5 1,4, для многоатом-
ного i 6, 8/6 1,3.
В воздухе больше всего азота (N2) и кислорода (O2) – двухатомных газов, поэтому для воздуха можно принять 1,4.
Примеры графиков изотермы и адиабаты показаны на рис.
16.4.
Примечание 7
Все процессы, которые вы рассмотрели выше, являются частными случаями, так называемого, политропного процесса, который описывается уравнением вида pVn const.
Действительно: |
|
|
|
|
в изобарном процессе |
n 0, |
CP const; |
в изотермическом процессе |
n 1, |
CТ ; |
|
|
в адиабатном процессе |
n , |
CАД 0; |
в изохорном процессе |
n |
CV const. |
|
Контрольные задания и вопросы
1.Сформулируйте первое начало термодинамики. Какой смысл имеют входящие в соответствующую формулу величины?
2.Что имеется в виду, когда говорят, что внутренняя энергия является функцией состояния? От чего зависит изменение внутренней энергии идеального газа?
3.В чём заключается суть теоремы о равном распределении энергии молекул идеального газа по степеням свободы? Поясните суть теоремы на примере молекул газов, входящих в состав атмосферы.
4.Выведите выражение для работы, совершаемой при расширении идеального газа.
156
5.Какие процессы называются обратимыми? Приведите примеры.
6.Что называется молярной теплоёмкостью? Что такое CV и CP? Как они рассчитываются в случае идеального газа?
7.Выведите уравнение Майера.
8.Какой процесс называется адиабатным? Запишите уравнение Пуассона для адиабатного процесса. Начертите график адиабаты в координатах p – V.
9.Запишите формулу первого начала термодинамики для разных изопроцессов, протекающих в идеальном газе.
10.Какой процесс называется политропным?
157
Лекция № 17 |
МОЛЕКУЛЯРНАЯ ФИЗИКА |
ИТЕРМОДИНАМИКА. ЧАСТЬ IV
17.1Тепловые машины. Цикл Карно
Первое начало термодинамики может быть использовано для описания работы тепловых двигателей – устройств, которые используют поступающее тепло для получения полезной работы.
В основе работы тепловых двигателей лежат круговые процессы (циклы), при которых система раз за разом возвращается в исходное состояние с тем, чтобы вновь начать совершать работу. Для расширения рабочее тело (в нашем случае – газ) нагревают (обеспечивающее нагрев устройство обозначают термином «нагреватель»), для того, чтобы он вновь сжался, его охлаждают (устройство для охлаждения называют «холодильник»). Изменение внутренней энергии идеального газа за полный цикл равно
нулю ( dU 0), поэтому работа A, совершаемая газом за один
цикл, оказывается равной разнице количеств теплоты, полученной от нагревателя QН и переданной холодильнику QХ: A QН QХ.
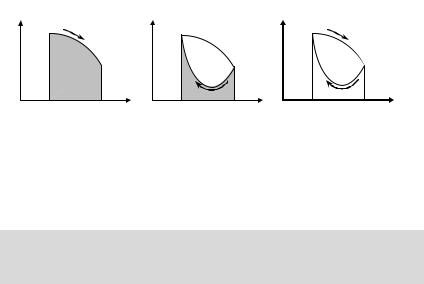
Схематически работа тепловой машины поясняется рис. 17.1.
|
|
На графике циклического процесса в |
|
НАГРЕВАТЕЛЬ, |
|
координатах p – V (рис. 17.2) работа, |
|
температура TН |
|
совершаемая газом при расширении из |
|
|
|
состояния с объёмом V1 в состояние с |
|
QН |
|
||
|
объёмом V2, численно равна площади |
||
|
|
||
|
|
под кривой 1 – 2 – 3 (рис. 17.2а), а ра- |
|
РАБОЧЕЕ |
A |
бота, совершаемая над газом при его |
|
сжатии от V2 до V1, – площади под кри- |
|||
ТЕЛО |
|
||
|
|
вой 3 – 2 – 1 (рис. 17.2б). Таким обра- |
|
QХ |
|
||
|
зом, полезная работа, совершаемая за |
||
|
|
||
ХОЛОДИЛЬНИК, |
|
цикл тепловым двигателем на основе |
|
температура TХ |
|
идеального газа, численно равна пло- |
|
|
|
щади, ограниченной замкнутой кривой |
|
|
|
||
Рис. 17.1 |
|
1 – 2 – 3 – 2 – 1 графика цикла в коор- |
|
|
|
динатах p – V (рис. 17.2в). |
158
p |
1 |
|
p |
1 |
|
p |
1 |
|
2 |
|
|
2 |
|
|
2 |
|
|
3 |
|
|
3 |
|
3 |
|
|
|
|
2 |
|
|
2 |
|
0 |
V |
0 |
|
V |
0 |
V |
|
а) |
|
|
б) |
|
|
в) |
|
|
|
|
Рис. 17.2 |
|
|
|
Тепло, передаваемое холодильнику, как правило, бесполезно теряется в окружающей среде.
Коэффициент полезного действия тепловой машины рассчитывается по формуле
|
A |
|
QН QХ |
. |
(17.1) |
|
|
||||
|
QН |
|
QН |
|
|
Очевидно: 1, и это подтверждает то, что невозможен пе-
риодически действующий двигатель, который совершал бы работу в большем количестве, чем получаемая им извне энергия (такое гипотетическое устройство называется «вечным двигателем первого рода»).
Проблема повышения к. п. д. тепловых машин привлекала пристальное внимание учёных. С этой целью совершенствовалась конструкция машин, варьировалось топливо нагревателя, менялся режим работы (форма кривой цикла)… Одновременно проводились теоретические исследования, в результате которых удалось показать, что максимально возможным к. п. д. должны обладать машины, цикл которых представляет собой обратимый процесс.
Термодинамический процесс называется обратимым, если он допускает возврат системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо из-
менения. Другими словами, после окончания обратимого цикла в исходное состояние должно возвращаться не только само рабочее тело машины (в нашем случае – газ), не только её элементы (шестерёнки, поршни, рычаги), но и все другие окружающие машину и связанные с ней тела. Примером обратимого процесса в меха-
159
