Лекция № 37. Реальные газы и фазовые переходы.
I.Отклонение реальных газов от идеальных газовых законов.Межмолекулярные силы.
|
|
Согласно закону Бойля-Мариотта PV=constдля данной массы газа при любом давлении, т.е. графически – это прямая. В действительности этот закон соблюдается лишь при: а) небольших давлениях; б) высоких температурах. На графике приведены изотермы H2. Причина отклонения: Газ H2при больших давлениях и низких температурах нужно рассматривать как реальный, т.е. необходим учёт межмолекулярных сил и конечных размеров молекул. |
Сжатие и сближение молекул приводит к заметному проявлению сил взаимодействия молекул. Силы, действующие между молекулами, в основном являются электрическими силами, действующими как силы притяжения разноименных зарядов (отрицательные силы), так и силы отталкивания одноимённых (положительные силы).
|
|
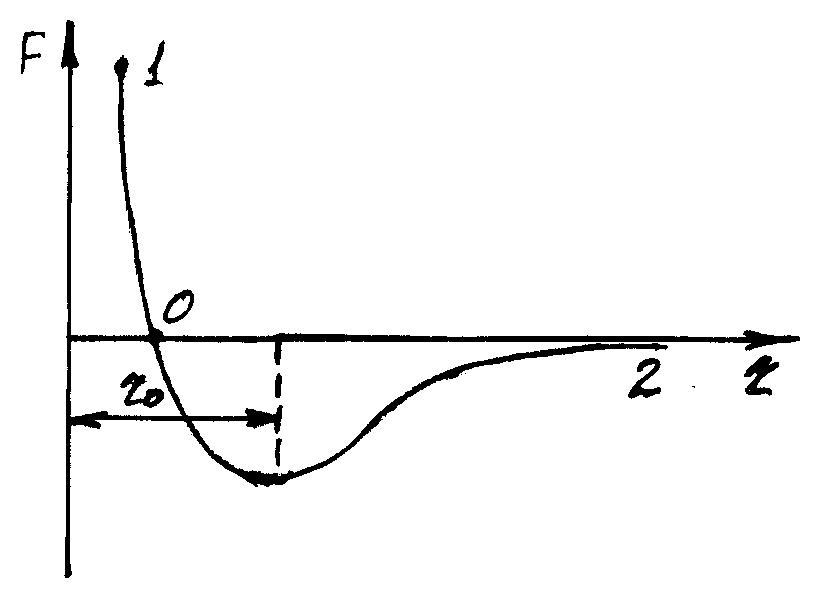
Характер изменения сил взаимодействия Fмолекул с изменением расстоянияrмежду их центрами. 01 – силы отталкивания (действие подобно упругому соударению, кратковременно действующее), молекулы не сближаются до соударения. 02 – силы притяжения. При r0–minпотенциальной энергии системы, наиболее устойчивое состояние. |
II.Уравнение Ван-дер-Ваальса.
Учёт конечных размеров молекул и сил взаимодействия между ними позволяет ввести поправки в уравнение Менделеева-Клапейрона и получить уравнение состояния идеальных газов.
Поправка на объём:
Из объёма Vзанятого газом вычесть величинуb, пропорциональную собственному объёму молекул.
(V–b) (1)
Поправка на взаимное притяжение:
Взаимное притяжение молекул создаёт давление, дополнительно к силам внешнего давления, как бы сжимающее газ. Добавочное внутреннее давление Р´. Тогда:
(Р + Р´) (2)
Вычисление поправки Р´ даёт, что:
![]() (3)
(3)
где а – постоянная, которая зависит от газа.
Уравнение Ван-дер-Ваальса (Голландия, 1873):
![]() для 1 моля (4)
для 1 моля (4)
а и b– определяются экспериментально
![]() для ν молей , (5)
для ν молей , (5)
где ν – число молей.
|
|
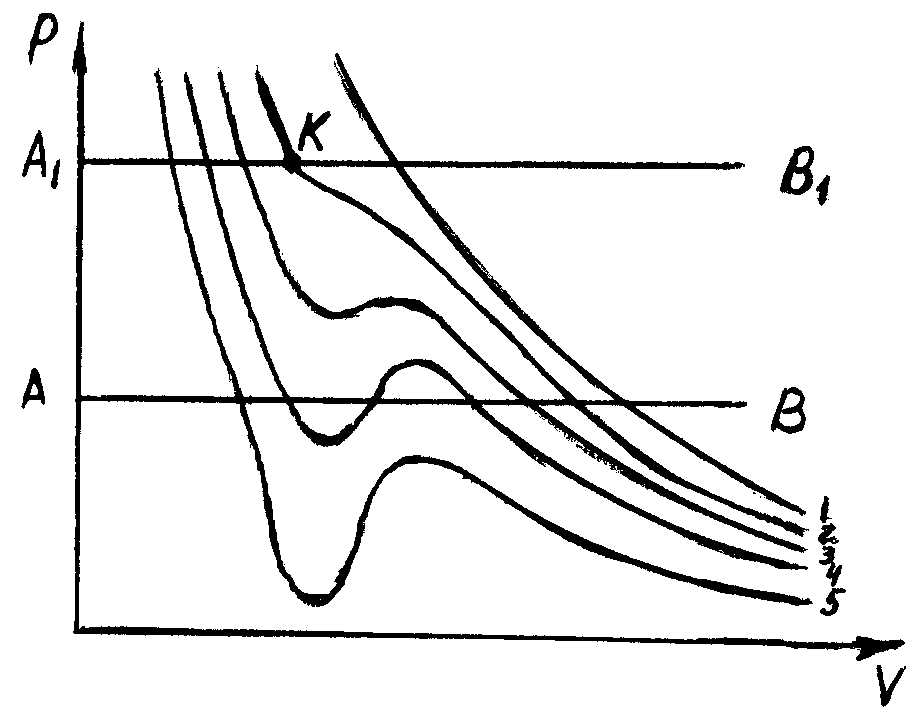
Уравнения (4) и (5) – кубические относительно объёма. Поэтому для заданных PиTони должны иметь три корня. А объём соответственно может иметь 3 значения или одно (когда два корня мнимых – они не годятся, т.к. V– вещественная величина). Уравнение Ван-дер-Ваальса при различных T: T1 > T2 > T3 > T4 > T5 Проведём две изобары и относительно них исследуем эту серию кривых. Пересечение изобары с изотермой даёт точки с соответствующими параметрами состояния. |
1. При высоких t(кривая 1) одна точка пересечения (один вещественный корень), т.е. каждому значениюPиTодно значениеV.
Вывод: при высоких tвещество находится в однородном состоянии.
2. При нормальных tимеется три точки пересечения (кривая 4), три вещественных корня, т.е. каждому значениюPиTсоответствует три значения объёмаV.
Вывод: при нормальных tвещество может одновременно находиться в трёх фазовых состояниях.
3. При повышении t(от 5 к 1) изгибы на изотермах сглаживаются и переходят в одну точку перегиба К. Точка К на изотерме 2 соответствует состоянию, при котором вещество может одновременно в этой точке находиться в любом агрегатном состоянии, или по другому – нельзя отличить одну фазу от другой. Точка К характеризует состояние, называемоекритическим, а параметры точки К, называютсякритическимии обозначаютсяPк,VкиTк.
4. При больших Vи небольшихPизотермы Ван-дер-Ваальса совпадают с изотермами Бойля-Мариотта.