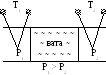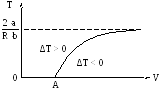III.Критическое состояние вещества.
Семейство кривых, рассмотренных ранее, является теоретическим. Физическая сущность выводов, сделанных ранее, может быть дана, если рассмотреть экспериментальные изотермы Ван-дер-Ваальса (труды Менделеева 1860 г., Авенариуса, Эндрюса и др.).
Теория совпадает с экспериментом за исключением участков [(5-5); (4-4); (3-3)]
|
|
5-5– однофазное газовое состояние (закон Бойля-Мариотта) 5-5– уменьшениеVприP=constсоответствует изменению агрегатного состояния (переход газ-жидкость). Вещество находиться в двухфазном состоянии. PH– давление насыщения. 5-5– однофазное жидкое состояние. – газовое состояние; – область двухфазного состояния – переход пара в жидкость. |
При достижении Ткобъёмы (следовательно и плотности) пара и жидкости сливаются (при этом совпадают молекулярные характеристики пара и жидкости), поэтому различия в свойствах пара и жидкости отсутствуют. Критическое состояние характеризуется непрерывным переходом пара в жидкость и жидкости в пар.
![]()
IV.Внутренняя энергия реальных газов.Явление Джоуля-Томсона.
Согласно закона Джоуля, внутренняя энергия идеального газа Uскладывается из кинетических энергий поступательного и вращательного движений молекул и равна:
![]()
где ![]() –
средняя мольная теплоёмкость.
–
средняя мольная теплоёмкость.
В случае реального газа нужно учесть ещё потенциальную энергию взаимодействия молекул, зависящую от вандерваальсовских сил. Эта добавочная энергия равна:
![]()
Тогда полная внутренняя энергия:
![]() (6)
(6)
|
|
Разберём опыт Джоуля и Томсона. В Опыт даёт: для большинства газов при комнатной температуре происходит охлаждение, некоторые газы (H2 иHe) дают повышение температуры. Разберём явление для моля газа. |
Рассмотрим вопрос расширения реального газа при адиабатическом процессе. Нас интересует вопрос: как меняется внутренняя энергия газа, а следовательно и его температура.
По закону сохранения энергии, с учётом адиабатности ∆Q= 0 , имеем:
U1 +P1V1=U2 +P2V2,
где U1иU2– внутренняя энергия газа до и после расширения;
P1V1– работа внешних сил при перемещении газа;
P2V2 – работа расширения газа.
∆U= U2 – U1= P1V1 – P2V2 (7)
Рассмотрим предельные случаи:
1. Молекулы имеют конечный объём, но нет взаимодействия:
b 0; P´ = 0
P·(V – b) = R·T P·V = R·T + b·P
∆U = R·T1 + b·P1 – R·T2 – b·P2 = R·( T1 – T2 ) + b·( P1 – P2 )
т.к. ∆Т << ∆P> 0, то ∆U> 0, следовательно Т повышается (∆Т > 0)
2. Есть взаимодействие, а объёмом молекул пренебрегаем:
![]()
![]()
![]()
т.к.
![]() то
то
∆U< 0, следовательно Т понижается (∆Т < 0).
∆Т > 0 – отрицательное явление Джоуля-Томсона – температура увеличивается.
∆Т < 0 – положительное явление Джоуля-Томсона – температура понижается.
3. Общий случай.
b0;P´0
Подстановка уравнения Ван-дер-Ваальса в уравнение (7) даёт:
![]() (8)
(8)
Знак ∆Т определяется выражением в скобках. Рассматриваем его как уравнение:
![]()
где 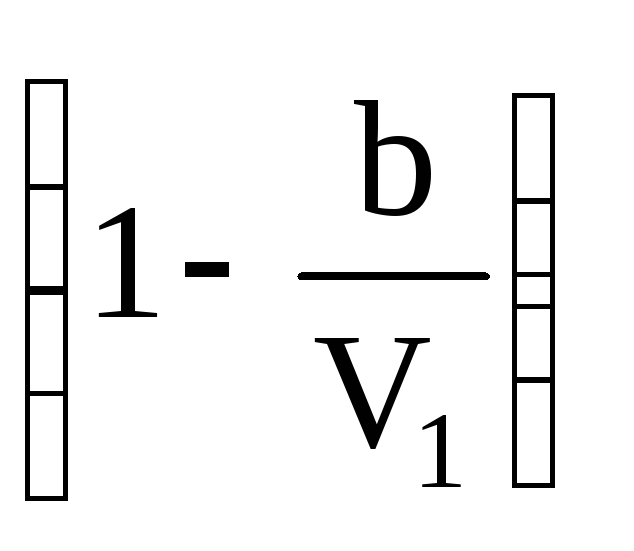 –
гипербола.
–
гипербола.
|
|
Область над кривой ΔT> 0 Область под кривой ΔT< 0 Точки кривой соответствуют температуре, при переходе которой явление меняет знак.
|
Величина объёма V=OAпоказывает критическое значение объёма, при котором возможен положительный эффект явления Джоуля-Томсона.
Положительный эффект ΔT< 0 используется при сжатии газов для получения низких температур.


 –
жидкое состояние;
–
жидкое состояние;