
- •Міністерство освіти і науки України
- •1. Властивості порошків
- •1.1. Хімічні властивості
- •1.2. Фізичні властивості
- •Методи визначення розміру частинок
- •1.3. Технологічні властивості
- •2. Механічні методи отримання порошків
- •2.1. Загальні положення
- •2.2. Характеристика обладнання для подрібнення
- •Він пропонує у цьому виразі замінити поточні напруги на межу міцностіматеріалу, що дозволить визначити роботу, яка виконується під час подрібнення матеріалу об’ємомза один цикл. Ця робота дорівнює:
- •Витрати роботи залежно від етапу руйнування
- •2.4. Вплив рідин та пар на процес подрібнення матеріалів
- •3. Отримання порошків розпиленням розплавів
- •3.1. Загальні положення
- •Математично залежності можна описати емпіричним рівнянням
- •Значення критеріїв Re та Lp для різних умов розпилення
- •3.2. Вплив різних факторів на процес розпилення розплавів газами
- •Гранулометричний склад порошку заліза, одержаного розпиленнямрозплавів сплавів заліза
- •Поверхневий натяг розплавів заліза з киснем, азотом, сіркою та фосфором
- •Коефіцієнт тепловіддачі конвекцією можна визначити за виразом
- •Теплофізичні властивості газів
- •3.3. Розпилення рідиною
- •Значення коефіцієнта тепловіддачі для умов розпилення розплавів водою
- •3.4. Формування складу і структури порошків під час розпилення розплавів
- •3.5. Технологічні особливості отримання порошків розпиленням
- •Режими одержання порошків розпиленням
- •4. Отримання порошків металів і сплавів відновленням з оксидів та інших сполук
- •4.1. Основи термодинаміки відновлювальних процесів
- •4.2. Механізм і кінетика відновлювальних процесів.
- •4.3. Закономірності отримання порошків металів їх
- •4.4.1. Отримання металів відновленням
- •Оксиди відновлюють відповідно до принципу послідовності
- •4.4.2. Магнієтермічне відновлення солей металів
- •4.4.3. Натрієтермічне відновлення солей металів
- •4.5. Отримання порошків сплавів
- •4.5.1. Сумісне відновлення оксидів металів воднем
- •Константи рівноваги
- •4.5.2. Сумісне відновлення сумішів оксидів і металевих порошків
- •4.5.3. Метод термодифузійного насичення з точкових джерел
- •1100 С (протягом 6 год) від їх умісту у вихідній шихті:
- •4.6. Технологічні основи отримання порошків металів та сплавів
- •Відновлення
- •5.1.2. Вплив різноманітних чинників на властивості порошків металів під час їх отримання електролізом водних
- •5.1.3. Особливості отримання порошків сплавів
- •5.1.4. Технологічні основи отримання порошків металів електролізом водних розчинів їх солей
- •11 _ Діафрагма
- •5.2. Електроліз розплавлених середовищ
- •5.2.1. Технологічні основи отримання порошків металів електролізом розплавлених середовищ
- •5.3. Автоклавний метод отримання порошків
- •5.4. Отримання порошків цементацією
- •5.5. Отримання порошків міжкристалевою корозією
- •6. Газові методи отримання порошків
- •6.1. Дисоціація карбонілів
- •7. Отримання порошків безкисневих тугоплавких сполук
- •7.1. Властивості та застосування безкисневих
- •Властивості тугоплавких сполук
- •7.2. Отримання порошків карбідів
- •Фази кінцевого продукту
- •Склад карбідів, одержаних методом свс
- •Характеристики карбіду титану отриманогометодомСвс
- •Умови осадження карбідів з газової фази
- •7.3. Отримання порошків нітридів
- •Умови отримання і склад нітридів, одержаних азотизацією металів
- •Умови осадження нітридів з газової фази
- •7.4. Отримання порошків боридів
- •7.5. Отримання порошків силіцидів
- •Температурні режими отримання силіцидів осадженням з газової фази
- •7.6. Отримання порошків неметалевих тугоплавких сполук
- •Газоподібний утворюваний силіцій, взаємодіючи з вуглецем, утворює силіцію
- •7.7. Отримання порошків литих тугоплавких сполук
- •Вихідні матеріали
- •Хімічний склад плавлених карбідів титана
- •Властивості плавлених карбідів
- •8. Отримання волокон та вусів
- •8.2. Методи отримання волоконта вусів
4.5.3. Метод термодифузійного насичення з точкових джерел
Метод, поряд з кальцієгідридним методом, набуває широкого застосування для отримання порошків сплавів у промислових обсягах. Його використовують для отримання порошків сплавів на основі заліза легованими елементами, що утворюють важковідновлювальні оксиди (Ti, V, Cr, Mn, S та ін). Сутність методу: беруть потрібну кількість порошків вихідних металів і хлористий амоній (NH4Cl), перемішують їх у кульових млинах за малого кульового навантаження (100 г куль на 1 кг шихти), завантажують у герметичний контейнер і нагрівають до температури 1000…1100 С. Ізотермічне витримування за цієї температури – 4…6 год. Порошки вихідних металів іноді замінюють оксидами, що більш ощадливо. Із нагріванням шихти хлористий амоній розкладається з утворенням хлористого водню і аміаку:
NH4Cl = NH3+HCl.
Хлористий водень взаємодіє з металевими порошками, в результаті чого утворюються хлориди відповідних металів, які надалі беруть участь у процесі дифузійного насичення. Кількість утворених хлоридів металів залежить від умов процесу.
Основні реакції дифузійного насичення з точкових джерел у загальному вигляді можуть бути такими:
Me + n HCl = Me Cln + n/2 H2 ; (4.13)
Me + mHCl = Me Cl + m/2 H2 ; (4.14)
nMe + mMe Cln = nMeCln + mMe. (4.15)
У результаті реакцій (4.13) і (4.14) утворюються хлориди металів у складі шихти, а відповідно до реакції (4.15) – хлориди взаємодіють з поверхнею металевих порошків з утворенням активних атомів металів, які дифундують у глибину металу, на поверхні якого вони виділились, утворюючи сплав. При цьому можливе як одностороннє, так і двостороннє перенесення. В основі спрямованого перенесення металів через газову фазу лежать закономірності, пов’язані з їх властивостями та властивостями їх хлоридів. За теорією, розробленою І. Д. Радомисельським, С. Г. Напара-Волгіною, І. А. Мартюхіним, напрям перенесення металів можна пов’язати з ізобарно-ізотермічним потенціалом реакції утворення хлоридів з простих речовин, а взаємодія з HCl – з теплотою сублімації і енергією кристалічної гратки металів. Значення деяких елементів та їх з’єднання з хлором наведеновтабл. 4.4.
Метал переноситься від речовини, що зазнала значної зміни ізобарно-ізотермічною потенціалу під час його утворення, до речовини з меншою її зміною чи від металу з меншою теплотою сублімації і енергією кристалічної гратки до металу з великими значеннями цих величин.
Елементи, що розміщені
вище водню (табл. 4.4, стовпчик
1), можуть утворювати хлориди під час
взаємодії з HCl. Хлориди
металів, що розміщені нижче водню,
відновлюються воднем. Значення
ізобарно-ізотермічного потенціалу для
цих реакцій наведеновстовпчику 4(табл. 4.4).Елементи, що розміщені поряд з воднем
і мають порівняльні значення
![]() ,
можуть як утворювати хлориди, так і
відновлюватись воднем залежно від
парціальних тисків газоподібних
компонентів реакції. Виходячи зі значень
ізобарно-ізотермічного потенціалу
(табл.4.4, стовпчики 6–12),
кожний елемент може відновлювати хлориди
елементів, що стоять нижче. Наприклад,
хлорид вольфраму може бути
,
можуть як утворювати хлориди, так і
відновлюватись воднем залежно від
парціальних тисків газоподібних
компонентів реакції. Виходячи зі значень
ізобарно-ізотермічного потенціалу
(табл.4.4, стовпчики 6–12),
кожний елемент може відновлювати хлориди
елементів, що стоять нижче. Наприклад,
хлорид вольфраму може бути
відновлений усіма наведеними елементами, а хлорид хрому – тільки марганцем.
Одночасно з відновленням хлоридів, що супроводжується утворенням активних атомів металів, утворюється хлористий водень за реакцією
MeCln + n/2 H2 = Me + nHCl,
який взаємодіє з металевими порошками, утворює нові порції хлоридів, тобто повторюються циклічні реакції. Ця обставина має важливе практичне значення, оскільки дає змогу вводити у вихідну шихту набагато менше хлористого амонію,ніжйого потрібно для переведення всіх вихідних металів у хлориди.
Для отримання порошків сплавів з вихідної шихти, що містить оксиди металів, у реакційний простір як відновник зазвичай вводять вуглець.
Отже, розглянутий процес отримання сплавів має такі особливості: хлорування різних оксидів навіть одного металу значно залежить від їх кристалічної структури, температури процесу, кількості хлористого водню у газовій фазі, наявності вуглецевмісних відновників. Можливі умови, за яких утворення хлоридів металів з меншою енергією кристалічної гратки буде термодинамічно менш вигідне через високу енергію активізації хлорування оксиду. Тоді через відсутність чи низький парціальний тиск хлоридів з малою теплотою сублімації буде спостерігатись перенесення на оксид речовини з більшою теплотою сублімації.
За наявності вуглецю термодинамічні та кінетичні умови хлорування оксидів полегшуються, що зумовлено його участю в процесах відновлення у вигляді СО. При цьому процес газифікації вугілля полегшується сублімацією хлоридів і їх адсорбцією на поверхні частинок сажі. За наявності хлористого водню і хлоридів, пари води і кисню, що адсорбуються на поверхні вуглецю і утворюються в процесі хлорування, можуть реагувати з вугіллям за нижчих температур згідно з реакціями
2C+O2 =2СО за температури 350...400 ºС,
С + Н2О = Н2 + СО за температури 500...600 ºС.
Таблиця 4.4
Термодинамічні характеристики деяких елементів за температури 1373 С та їхсполукз хлором*
|
Еле- мент |
Ізобарно-ізотермічний потенціал, кДж/моль |
Теплота сублімації
|
Енергія кристалічної гратки Е10-3, ,кДж/(кгмоль) | |||||||||
|
Утворення хлору |
Відновлення із хлориду елементами | |||||||||||
|
Із прос-тих речо-вин |
У разі взаємо- дії з HCl |
Хлорид |
Mn |
Cr |
Si |
H2 |
Fe |
Ni |
W | |||
|
Mn Cr Si H2 Fe Ni W |
-330,5 -238,9 -212,5 -207,0 -202,0 -144,5 -89,0 |
-122,9 -31,7 -5,43 - +5,02 +62,7 +117,4 |
MnCl2 CrCl2 ЅSiCl4 2HCl FeCl2 NiCl2 1/3WCl6 |
- - -117,4 -122,9 -127,9 -185,2 -240,8 |
+91,1 +26,3 -26,3 -31,7 -36,8 -94,0 -149,2 |
+117,4 +26,3 - -5,43 -10,45 -68,6 -122,9 |
+122,9 +31,7 +5,43 - -5,02 -62,7 -117,4 |
+127,9 +36,8 +10,4 +5,03 - -57,3 -112,4 |
+185,2 +94,0 +69,6 +6,27 +57,3 - -55,12 |
+240,8 149,2 122,9 117,46 112,4 55,12 - |
293,5 396,1 436,9 - 417,18 424,1 845,3 |
286,0 337,5 370,0 - 409,5 426,0 905,0 |
*Реакції утворення хлоридів: mMe + nHCl = MemCln + n/2 H2; Реакції відновлення хлоридів: MemCln + n/2 H2 = mMe + nHCl
Наявність СО в газовому середовищі сприяє перебігу реакції за участю вуглецю. Сумарні реакції відновлення і хлорування за температури,вищої від 900С,у цьому разі мають вигляд:
MeO + HCl + C = MeCl + H2 + CO2 .
За наявності вуглецю можливе також безпосереднє відновлення оксидів одних металів хлоридами інших:
MeO + MeCln + C = Me + MeCl2 + CO2 .
У разі отримання порошків сплавів насичення з точкових джерел з використанням як вихідних матеріалів чистих порошків металів та їх оксидів механізм кінцевої стадії сплавоутворення полягає в тому, що хлорид одного елемента відповідно до напряму його перенесення, визначений термодинамічними характеристиками процесу, адсорбується на поверхні іншого в місцях найбільшої дефектності. При цьому відбувається хемосорбція. Зв’язок між атомами в молекулі хлориду послаблюється і хлор взаємодіє з металом основи як акцептор електронів. Атом адсорбованого металу попадає в зону дії енергетичного поля кристалічної гратки металу основи, захоплюється нею і дифундує в глибину, утворюючи сплав. Поряд з цим відбувається десорбція утворюваного хлориду з поверхні металу основи з переходом його в газову фазу, де він відновлюється воднем чи переноситься до металу з більшим значенням ізобарно-ізотермічного потенціалу реакції утворення хлориду.
Можливий також інший механізм, за яким відбувається хемосорбція хлориду одного металу на іншому із подальшою взаємодією атомів хлору з воднем:
MeCl2+H2=Me* + 2HCl.
Активні атоми металу (Ме*) дифундують в глибину кристалічної гратки металу основи, а хлористий водень десорбується в газову фазу і потім бере участь у регенерації хлоридів металів, що входять до складу шихти. Згідно з першим механізмом відбувається адсорбція хлориду за схемою:
MeCl2 +Me(MeCl2.Me);
хімічна реакція в адсорбованому прошарку:
(MeCl2 . Me) (Me . MeCl2)
дифузія і десорбція
(Me . MeCl2) (Me+) + MeCl2
і відновлення хлориду
MeCl2 + H2 Me + 2HCl.
Відповідно до другого механізму відбувається адсорбція хлориду
MeCl2 + Me (MeCl2 . Me)
і реакції в адсорбованому прошарку:
(MeCl2 . Me) (Me . Me) + (Clг);
(Cl2)адс+
H2
2(HCl)адс
![]() 2HClг.
2HClг.
Розглянуті процеси можливі, якщо забезпечується інтенсивне відведення утворюваних активних атомів металу і виведення із зони реакції хлористого водню; інтенсифікуються за високих температур унаслідок термічного активування дифузії і хімічних реакцій хлорування за наявності хлористого водню.
Оптимальні температури процесів отримання сплавів насичення з точкових джерел – з 1100…1150 С для отримання низько- і середньолегованих сплавів до 1180С для отримання високолегованих сталей. При цьому час ізотермічного витримування становить у першому випадку 3…4 год, а в другому – до 5 год.
Для нормального процесу отримання порошків сплавів, як відомо, важливе значення має кількість уведеного до складу вихідної шихти хлористого амонію. Для успішного проходження процесу його достатньо 1…2%. Попри те, що під час розкладання цієї сполуки утворюється мало хлоридів, надалі в результаті циклічно повторюваної реакції регенеруються HCl і хлориди.
За неперервної регенерації хлоридів забезпечується перенесення речовини через фазу і утворення в кінцевому підсумку гомогенних сплавів потрібного складу. Однак оптимальною масового часткою уведеного хлористого амонію варто вважати 10%. У разі нижчого його вмісту отриманий продукт являє собою щільну губку, яка важко піддається роздрібненню. Крім того, отримані в цьому випадку сплави не завжди гомогенні, що зумовлено погіршенням газопроникності шихти внаслідок її спікання. Це ускладнює дифузійний механізм перенесення газоподібних складових реакцій по парових каналах. Гомогенність сплавів можна підвищити, якщо до складу вихідної шихтиразомз хлористим амонієм увести розпушувач,заякий доцільно використовувати двовуглецевий амоній (NH4)2CO3. Наприклад, для отримання порошку сталі Х3О рекомендується вводити 3% NH4Cl і 12…17% (NH4)2CO3.
За наявності в шихті понад 10% NH4Cl губчастий продукт легко подрібнюється, а утворений сплав – гомогенний. Однак при цьому знижується вміст легувальних елементів на відміну від отримання використовуваних для сплавів залізо–силіцій (рис. 4.13, 4.14), оскільки зі збільшенням концентрації NH4Cl зростає вміст у кінцевому продукті не прореагованих хлоридів металів. Коефіцієнт використання легувальних елементів, що містяться у вихідній шихті,становить80…90%.
На гомогенність отриманих порошків сплавів поряд з наявністю хлористого амонію впливають час ізотермічного витримування і розмір частинок порошків металу основи. Гомогенність сплавів, за інших однаковихумов,підвищується зі збільшенням ізотермічного витримування за температури процесу, зумовлено інтенсивнішими дифузійними процесами як основи сплавоутворення. Зазвичай оптимальний час ізотермічного витримування становить 3…5 год,алезростає зі збільшенням легувальних елементів та розміру частинок порошку основи, не перевищуючи при цьому 5…6 год.
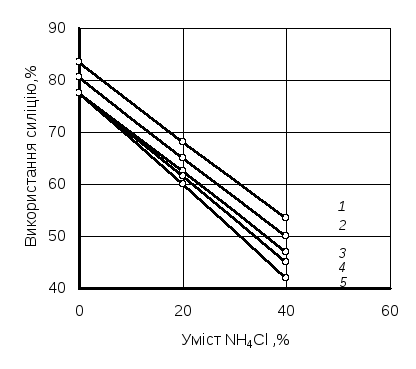
Рис. 4.13. Залежність частки використання силіцію від умісту
у вихідній шихті NH4Cl за таких температур процесу оС:
1 – 700; 2 – 900; 3 – 800; 4 – 1000; 5 – 1100

Рис. 4.14. Залежність умісту елементів у двокомпонентних
сплавах Fe-Si (Ti, Cr, Mn), отриманих за температури
