
- •Міністерство освіти і науки України
- •1. Властивості порошків
- •1.1. Хімічні властивості
- •1.2. Фізичні властивості
- •Методи визначення розміру частинок
- •1.3. Технологічні властивості
- •2. Механічні методи отримання порошків
- •2.1. Загальні положення
- •2.2. Характеристика обладнання для подрібнення
- •Він пропонує у цьому виразі замінити поточні напруги на межу міцностіматеріалу, що дозволить визначити роботу, яка виконується під час подрібнення матеріалу об’ємомза один цикл. Ця робота дорівнює:
- •Витрати роботи залежно від етапу руйнування
- •2.4. Вплив рідин та пар на процес подрібнення матеріалів
- •3. Отримання порошків розпиленням розплавів
- •3.1. Загальні положення
- •Математично залежності можна описати емпіричним рівнянням
- •Значення критеріїв Re та Lp для різних умов розпилення
- •3.2. Вплив різних факторів на процес розпилення розплавів газами
- •Гранулометричний склад порошку заліза, одержаного розпиленнямрозплавів сплавів заліза
- •Поверхневий натяг розплавів заліза з киснем, азотом, сіркою та фосфором
- •Коефіцієнт тепловіддачі конвекцією можна визначити за виразом
- •Теплофізичні властивості газів
- •3.3. Розпилення рідиною
- •Значення коефіцієнта тепловіддачі для умов розпилення розплавів водою
- •3.4. Формування складу і структури порошків під час розпилення розплавів
- •3.5. Технологічні особливості отримання порошків розпиленням
- •Режими одержання порошків розпиленням
- •4. Отримання порошків металів і сплавів відновленням з оксидів та інших сполук
- •4.1. Основи термодинаміки відновлювальних процесів
- •4.2. Механізм і кінетика відновлювальних процесів.
- •4.3. Закономірності отримання порошків металів їх
- •4.4.1. Отримання металів відновленням
- •Оксиди відновлюють відповідно до принципу послідовності
- •4.4.2. Магнієтермічне відновлення солей металів
- •4.4.3. Натрієтермічне відновлення солей металів
- •4.5. Отримання порошків сплавів
- •4.5.1. Сумісне відновлення оксидів металів воднем
- •Константи рівноваги
- •4.5.2. Сумісне відновлення сумішів оксидів і металевих порошків
- •4.5.3. Метод термодифузійного насичення з точкових джерел
- •1100 С (протягом 6 год) від їх умісту у вихідній шихті:
- •4.6. Технологічні основи отримання порошків металів та сплавів
- •Відновлення
- •5.1.2. Вплив різноманітних чинників на властивості порошків металів під час їх отримання електролізом водних
- •5.1.3. Особливості отримання порошків сплавів
- •5.1.4. Технологічні основи отримання порошків металів електролізом водних розчинів їх солей
- •11 _ Діафрагма
- •5.2. Електроліз розплавлених середовищ
- •5.2.1. Технологічні основи отримання порошків металів електролізом розплавлених середовищ
- •5.3. Автоклавний метод отримання порошків
- •5.4. Отримання порошків цементацією
- •5.5. Отримання порошків міжкристалевою корозією
- •6. Газові методи отримання порошків
- •6.1. Дисоціація карбонілів
- •7. Отримання порошків безкисневих тугоплавких сполук
- •7.1. Властивості та застосування безкисневих
- •Властивості тугоплавких сполук
- •7.2. Отримання порошків карбідів
- •Фази кінцевого продукту
- •Склад карбідів, одержаних методом свс
- •Характеристики карбіду титану отриманогометодомСвс
- •Умови осадження карбідів з газової фази
- •7.3. Отримання порошків нітридів
- •Умови отримання і склад нітридів, одержаних азотизацією металів
- •Умови осадження нітридів з газової фази
- •7.4. Отримання порошків боридів
- •7.5. Отримання порошків силіцидів
- •Температурні режими отримання силіцидів осадженням з газової фази
- •7.6. Отримання порошків неметалевих тугоплавких сполук
- •Газоподібний утворюваний силіцій, взаємодіючи з вуглецем, утворює силіцію
- •7.7. Отримання порошків литих тугоплавких сполук
- •Вихідні матеріали
- •Хімічний склад плавлених карбідів титана
- •Властивості плавлених карбідів
- •8. Отримання волокон та вусів
- •8.2. Методи отримання волоконта вусів
4.4.1. Отримання металів відновленням
їх оксидів кальцієм і гідридом кальцію
Найчастіше кальцій застосовують для отримання порошків титану, цирконію і ванадію. Основу цих процесів становлять реакції:
TiO2 + 2Ca = Ti + 2CaO + Q;
ZrO2 + 2Ca = Zr + 2CaO + Q;
V2O5 + 5Ca = 2V + 5CaO + Q.
Відновлення проводять у герметичних реакторах (рис. 4.10), які після завантаження їх вихідною сировиною вакуумують та заповнюють аргоном чи воднем. Інертне середовище або відновлювальне газове середовище потрібне для запобігання взаємодії відновлюваного металу з азотом і киснем повітря. З цієї ж причини для відновлення варто використовувати кальцій, вільний від домішок азоту та інших елементів.
Оксиди відновлюють відповідно до принципу послідовності
А. А. Байкова від вищих оксидів до нижчих. При цьому варто мати на увазі, що визначальною стадією відновлення може бути взаємодія твердого розчину кисню в металі, як у разі відновлення ванадію, коли найбільш термодинамічно стійким за температури 1000 °С є твердий розчин кисню у ванадії із вмістом кисню 0,13%.
Хоч реакції перебігають з виділенням теплоти, зазвичай їх термічність недостатня для спонтанного процесу. У зв’язку з цим застосовують зовнішнє підігрівання і відновлення проводять за температур 1000…1100, 950…1100 і 1000°С протягом 1…2 год для отримання відповідно титану, цирконію і ванадію. Застосування таких температур сприяє розплавленню кальцію і частковому його випаровуванню, що забезпечує якісний його контакт з відновлюваним оксидом.
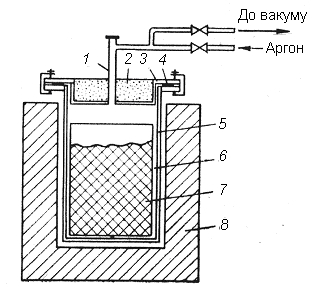
Рис. 4.10. Схема установки для металотермічного відновлення оксидів
металів кальцієм:
1 – патрубок; 2 – теплоізоляційна засипка; 3 – кришка; 4 – ущільнювач;
5 – корпус; 6 – металевий тигель; 7 – брикетована шихта; 8 – електропіч
Якщо як відновник застосовувати гідрид кальцію за температур відновлення 900…1100 °С, гідрид розкладається з утворення кальцію і атомарного водню, який потім асоціює в молекули. Атомарний водень, поряд з рідким і газоподібним кальцієм, може брати участь у відновленні. Наявність у середовищі відновлення водню приводить до того, що в результаті реакції
МеО + СаН2 > МеН2 + СаО + Н2
утворюється гідрид металу, який після виділення його з продуктів відновлення нагрівають у вакуумі за температури 900 °С для отримання чистого металу. Іноді цю операцію поєднують з процесом отримання компактного металу чи виробів з нього.
Поряд з температурою на швидкість і повноту проходження процесу відновлення впливають кількість відновника і якість його контакту з оксидом.
Відновника зазвичай беруть на 25…100 % більше від теоретично необхідного. Для поліпшення контакту шихта ретельно перемішується і брикетується.
Регулювання гранулометричного складу порошків можливе в процесі відновлення оксидів цих металів кальцієм. Для отримання порошків, розмір частинок яких менший за 2…3 мкм, процес проводять з використанням шихт указаних складів. Отриманню дрібних частинок сприяє утворення твердого оксиду кальцію, що виступає в ролі роз’єднувача, який перешкоджає зростанню частинок металу. Якщо отримання дрібних частинок металу не є метою, то бажано отримати порошки з більш великими частинками, оскільки зі збільшенням дисперсності порошків у процесі гідрометалургійної обробки продуктів відновлення відбувається інтенсифікація взаємодії їх з киснем і азотом повітря. У результаті порошки з розміром частинок 1…3 мкм мають підвищений вміст кисню і азоту – відповідно 0,2…0,3 і 0,03…0,15%.
Для отримання порошків з більшими частинками та зниження вмісту домішок у них до складу вихідної шихти необхідно вводити речовини, що розчиняють оксид кальцію і забезпечують частинкам металу рухливість, потрібну для їх збільшення. Для відновлення кальцієм як таку домішку використовують хлористий кальцій. Механізм дії СаCl2 полягає в тому, що, будучи за температур відновлення в рідкому стані, він частково чи повністю розчиняє в собі утворений оксид кальцію, який виступає в ролі роз’єднувача. Якщо залежно від кількості добавленого хлористого кальцію і температури процесу не весь СаО розчиняється в СаCl2, то частинки залишку нерозчиненого СаО перекристалізовуються через розплав, набуваючи при цьому рухливості, що дозволяє їм об’єднуватись в більші частинки. Наприклад, для отримання титану повне розчинення СаО в СаCl2 відбувається за молярного співвідношення в шихті CaO : CaCl2 = 2:1. При цьому отримані частинки металу мають розмір 10…15 мкм і більше.
Поряд з розглянутим впливом домішка СаCl2 сприяє також повнішому відновленню. Це зумовлено тим, що в хлористому кальції розчиняється близько 20% кальцію і деяка кількість оксиду відновлюваного металу. Оксид металу розчиняється поряд з його взаємодією з СаCl2 за реакцією:
MeO2 + 2CaCl2 = MeCl4 + 2CaO.
Утворений хлорид металу взаємодіє у розчині з кальцієм з утворенням металу і СаCl2 за реакцією:
MeCl4 + 2Ca = Me + 2CaCl2.
Таким чином, створюються умови для постійного розчинення оксиду металу в СаCl2 з подальшим його відновленням, що сприяє збільшенню ступеня відновлення вихідного оксиду.
Отриманий після відновлення продукт із суміші частинок порошку, СаО і СаCl2 подрібнюють, розчиняють у воді для гасіння СаО і розчинення СаCl2. Осад порошку металу промивають розбавленими кислотами (оцтовою, азотною чи соляною) і водою, сушать у вакуумі за температури 40…50 °С.
