
- •Розрахунки в середовищі excel Розділ 1. Розрахунок кінетичних параметрів топохімічних реакцій
- •Індивідуальна самостійна робота
- •Розділ 2. Статистична обробка результатів експерименту
- •2.1. Кореляційний аналіз
- •2.2. Довірчий інтервал
- •Контрольні питання
- •Література
- •Розділ 3. Розрахунок кінетичних параметрів хімічних реакцій
- •Література
- •Розділ 4. Оптимізація об'єктів досліджень за моделями другого порядку
- •Література
- •Розділ 5. Розрахунки математичних моделей "склад - властивість"
- •Література
- •Розділ 6. Розрахунок кінетичних параметрів за дериватографічними даними
- •Індивідуальна самостійна робота
- •Контрольні питання
- •Розділ 7. Розрахунок очищення коксового газу від сірководню
- •Алгоритм розрахунку
- •Розділ 8. Розрахунок виробництва водню мембранним методом
- •Алгоритм розрахунку [1]
- •Контрольні питання
- •Розділ 9. Розрахунок паро – повітряної конверсії метану
- •Вихідні дані (додаткові)
- •Контрольні питання
- •Розділ 10. Розрахунок двоступеневої
- •Розділ 11. Розрахунок матеріального балансу синтезу метанолу
- •Розділ 12. Розрахунок матеріального балансу синтезу аміаку
- •Алгоритм розрахунку
- •Контрольні питання
- •Розділ 13. Розрахунок очищення газу від co2 розчином моноетаноламіну
- •Алгоритм розрахунку Розрахунок матеріального балансу виробництва
- •Стадія «тонкого» очищення
- •Стадія «тонкого» очищення
- •Концентрації компонентів суміші с(і)2відповідають даним таблиці 3.
- •2 Розрахунок теплового балансу виробництва
- •Де ∑m(mea)р-ну - сума витрат розчину меа на «грубе» та «тонке» очищення, кг меа/год.
- •3 Розрахунок насадкового абсорбера верхня частина абсорбера («тонке» очищення)
- •Алгоритм розрахунку
- •Швидкість захлинання абсорбера у верхній частині [3]:
- •Робоча швидкість газу у верхній частині абсорбера:
- •Нижня частина абсорбера («грубе» очищення)
- •Алгоритм розрахунку
- •Швидкість захлинання абсорбера у нижній частині [3]:
- •Робоча швидкість газу у нижній частині абсорбера:
- •4 Розрахунок тарілчастого абсорбера
- •Верхня частина абсорбера
- •Алгоритм розрахунку
- •Нижня частина абсорбера
- •Алгоритм розрахунку
- •Промисловий абсорбер має 15 тарілок: 9 в нижній частині і 6 у верхній.
- •Розділ 14. Аналіз статики іонного обміну однозарядних (рівнозарядних) іонів
- •Рівновага іонного обміну рівновалентних іонів
- •Алгоритм розрахунку
- •Контрольні питання
- •Література
- •Розділ 15. Аналіз статики іонного обміну різнозарядних іонів
- •Алгоритм розрахунку
- •Контрольні питання
- •Література
- •Розділ 16. Розрахунок очищення газу від оксиду карбону (IV) гарячим розчином поташу
- •1 Матеріальний розрахунок
- •Алгоритм розрахунку
- •1.1 Розрахунок грубого очищення
- •1.2 Розрахунок тонкого очищення
- •2 Тепловий баланс поташного очищення конвертованого газу
- •Алгоритм розрахунку
- •3 Конструктивні розрахунки насадкового абсорберу
- •3.1 Розрахунок діаметру абсорберу Нижня зона
- •Алгоритм розрахунку
- •Верхня зона
- •Алгоритм розрахунку
- •3.2 Розрахунок висоти насадки
- •Верхня зона
- •Алгоритм розрахунку
- •Нижня зона
- •Алгоритм розрахунку
- •1. Розрахувати реальний вміст компонентів k2co3,kнco3і н2о в розчинах згідно даних таблиці 10. Врахувати стехіометрію реакції
- •Розрахунок матеріального балансу
- •Розрахунок теплового балансу
- •Алгоритм розрахунку
- •Конструктивний розрахунок
- •Алгоритм розрахунку
- •Індивідуальна самостійна робота
- •Контрольні питання
- •Література
- •Розрахунки в середовищіmathcad розділ 18. Розрахунок рівноваги оборотних реакцій
- •Розділ 19. Розрахунок трубчатого реактора конверсії природного газу
- •Алгоритм розрахунку
- •Розділ 20. Розрахунок рівноваги пароповітряної конверсії метану
- •Розділ 21. Розрахунок окиснення оксиду сульфуру (IV)
- •Контрольні питання
- •Література
- •Розділ 22. Альтернативний розрахунок матеріального балансу синтезу аміаку
- •Контрольні питання
- •Розділ 23. Альтернативний розрахунок матеріального балансу синтезу метанолу
- •Розділ 24. Розрахунок паро-вуглекислотної конверсії природного газу
- •Індивідуальна самостійна робота
- •Контрольні питання
- •Розділ 25. Розрахунок вуглекислотної рівноваги у водних розчинах
- •Алгоритм розрахунку
- •Значення рН буде приймати значення 4, 5, 6, 7, ..... До значення –log(Kw). Важливо! Отримані числові значення параметра не утворюють матрицю, тому з ними не можливі дії, що застосовуються до матриці.
- •Індивідуальна самостійна робота
- •Контрольні питання
- •Розділ 26. Аналіз динаміки іонного обміну однозарядних іонів
- •2 Хвильове рівняння для концентрації
- •3 Рівняння збереження в безрозмірній формі [1]
- •4 Рівняння ізотерми іонного обміну
- •5 Рішення хвильового рівняння методом характеристик [1]
- •6 Розрахунок обміну однозарядних іонів[1]
- •Алгоритм розрахунку
- •Вихідні дані для 1-ої ступені водопідготовки
- •Алгоритм розрахунку
- •Індивідуальна самостійна робота
- •Література
- •Розділ 27. Термодинамічний та матеріальний розрахунки газифікації вугілля
- •Розділ 28. Термодинамічний розрахунок газифікації (конверсії) вуглеводнів
- •Алгоритм розрахунку
- •.Індивідуальна самостійна робота
- •Контрольні питання
- •Література
- •Розділ 29. Розрахунок концентрацiй iонiв у вапнованiй та коагульованiй воді
- •Алгоритм розрахунку
- •Індивідуальна самостійна робота
- •Контрольні питання
- •Література
- •Розділ 30. Аналіз динаміки іонного обміну різнозарядних іонів
- •Алгоритм розрахунку
- •Індивідуальна самостійна робота
- •Література
- •Розділ 31. Термодинамічний розрахунок газифікації рідких палив невідомої формули
- •Алгоритм розрахунку
- •Індивідуальна самостійна робота
- •Розділ 32.Розрахунок поличних колон синтезу аміаку
- •Алгоритм розрахунку
- •Індивідуальна самостійна робота
- •Контрольні питання
- •Література
- •Методичні рекомендації до виконання розрахункової роботи
- •Розрахунок матеріального балансу виробництва
- •Розрахунок енергетичного (теплового) балансу виробництва
- •Розрахунок основних реакторів
- •Захист розрахункової роботи
- •Завдання на розрахункову роботу з дисципліни
2 Хвильове рівняння для концентрації
Функція q є складною функцією двох змінних: τ та с, тому її часткову похідну можна представити у вигляді:
![]()
та перетворити рівняння (3) матеріального балансу на:
![]() ,
(6)
,
(6)
де c(z, τ) - концентрація іонів В у розчині на момент часу τ на відстані z від входу в колонку.
Перетворимо дане рівняння у більш зручний вигляд. Для цього спочатку винесемо спільний множник за дужки:
![]() .
.
Перенесемо
вираз
![]() у праву частину рівняння:
у праву частину рівняння:
 .
.
Враховуючи те, що швидкість w постійна величина, приходимо до хвильової форми запису рівняння збереження (матеріального балансу):
 (7)
(7)
Позначимо
множник перед
![]() як:
як:
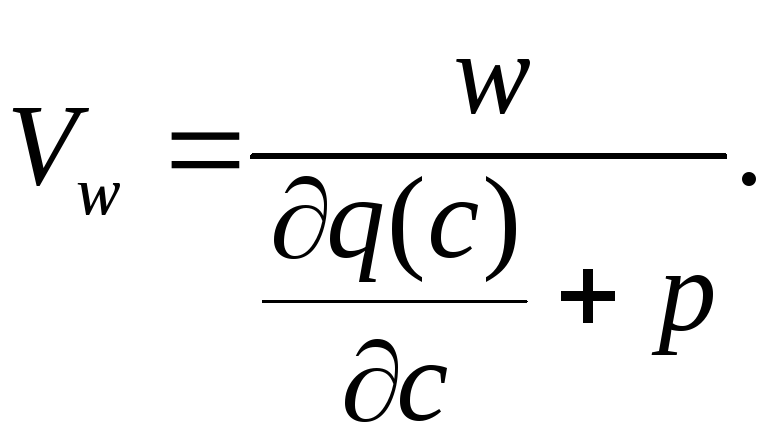 (8)
(8)
Параметр
![]() являє собою хвильову швидкість, тобто
є швидкістю пересування шаром іоніту
розчину з заданою концентрацією іона
та називається швидкістю пересування
концентраційних точок фронту. З
врахуванням виразу (8) рівняння (7)
перетворюється на:
являє собою хвильову швидкість, тобто
є швидкістю пересування шаром іоніту
розчину з заданою концентрацією іона
та називається швидкістю пересування
концентраційних точок фронту. З
врахуванням виразу (8) рівняння (7)
перетворюється на:
![]() .
(9)
.
(9)
3 Рівняння збереження в безрозмірній формі [1]
Незалежна змінна - координата - в безрозмірній і відносній формі вводяться наступним чином: Z=z/L; а незалежна змінна – час - в безрозмірній формі t= τ w/L.
Відносна концентрація домішок в розчині, залежна змінна: C=c(z,τ)/c0 , де с0 – сумарний вміст іонів А и В в розчині: с0=сA+сB. Відносна концентрація домішок в іоніті: Q=q(c)/q0 , де q0 – сумарний вміст іонів А и В в іоніті: q0=qA+qB – повна обмінна ємність іоніту.
При цьому Z, Q і С змінюються від 0 до 1.
Безрозмірна хвильова швидкість Vwave визначається як:
 .
.
Помножимо
чисельник та знаменник на
![]() :
: .
.
Враховуючи
вираз
![]() ,
остаточно отримуємо:
,
остаточно отримуємо:
 (10)
(10)
де
![]() - розподілювальне співвідношення.
- розподілювальне співвідношення.
Тоді рівняння матеріального балансу (9) в безрозмірній формі запишеться наступним чином:
![]()
![]() (11)
(11)
4 Рівняння ізотерми іонного обміну
Ізотерма
іонного обміну зазвичай дає залежність
активності іона
![]() (див. рівняння (1) – випадок рівнозарядних
іонів) в іоніті від його активності в
розчині в рівноважних умовах при заданій
температурі. Класична форма ізотерми
рівняння (5) за мономолекулярної адсорбції
задається рівнянням Ленгмюра (а –
коефіцієнт адсорбції):
(див. рівняння (1) – випадок рівнозарядних
іонів) в іоніті від його активності в
розчині в рівноважних умовах при заданій
температурі. Класична форма ізотерми
рівняння (5) за мономолекулярної адсорбції
задається рівнянням Ленгмюра (а –
коефіцієнт адсорбції):
![]() (12)
(12)
Тут і далі для спрощення активності іонів замінюються на їх концентрації. Формула (12) свідчить про те, що рівноважне значення q зменшується зі зменшенням концентрації розчину с на вході в фільтр. За великих значень концентрації с (а∙с >>1) рівноважне значення q наближається до q0 – значенню повної обмінної ємності.
У безрозмірній формі рівняння статики іонного обміну базується на більш точному рівнянні обмінної адсорбції (див. роботу Д1) і має вигляд:
![]() ,
(13)
,
(13)
де k – константа рівноваги – залежить від температури і визначає форму ізотерми іонного обміну (адсорбції).
За значень k >> 1 ізотерма адсорбції буде опуклою в координатах Q - C, отже іоніт переважно поглинає іони з розчину і рівняння (13) перетворюється на рівняння Ленгмюра (12).
При k << 1 – крива ізотерми адсорбції увігнута. У цьому випадку k характеризує процес витиснення іонів з іоніту.
Рівність k = 1 призводить до лінійної ізотерми Q = C. Це свідчить про те, що гіпотетичний іоніт не має жодної вибірковості до іонів А у порівнянні з іонами В.
