
- •1. Физическая химия: цель, задачи, методы исследования. Основные понятия физической химии.
- •3 .Следствия первого начала термодинамики ( изохорный и изобарный процессы). Способы записи теплот химических реакций.
- •4. Закон Гесса, его следствия. Взаимосвязь между тепловым эффектом химической реакции при постоянном объеме и давлении.
- •7. Зависимость тепловых эффектов химических реакций от температуры. Уравнение Киргоффа. Определение реакции при нестандартной температуре.
- •9. Работа расширения для идеальных газов при адиабатическом процессе. Вывести уравнения адиабат.
- •11. II закон термодинамики для обратимых и необратимых процессов. Свойства энтропии.
- •12.Расчет изменения энтропии для различных физико-химических процессов: нагревание, фазовые переходы, смешение идеальных газов, изобарный, изотермический, изохорныйпроцессы.
- •13. Расчет изменения энтропии реакции при стандартной и нестандартной температурах (на примере реакций с участием неорганических веществ)
- •14.Изохорно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса.
- •15. Изобарно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •16) Изобарно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •18) Уравнение Гиббса – Гельмгольца. Определение изменения энергии Гиббса реакции при не стандартной температуре.
- •19) Химический потенциал, определение, условие равновесия в открытых системах. Химический потенциал идеальных и реальных систем (газы, растворы).
- •20) Химическое равновесие, вывод уравнения изотермы химической реакции. Определение стандартного значения константы равновесия реакций.
- •23) Влияние температуры на константу равновесия, вывод уравнения изобары Вант- Гоффа. Принцип Ле- Шателье.
- •25) Расчёт теп.Эф х.Р. На основе изобары Вант-Гоффа (расчётный и граф. Способы).
- •26) Расчёт теп.Эф х.Р. На основе изохоры Вант-Гоффа (расчётный и граф. Способы).
- •27)Фазовые равновесия основные опр-я:
- •28)Равновесие чис-го в-ва в 2-х фазах одноком.Сис-мы.
- •29) Определение теплоты спарение расчетным и графическим способами на основе уравнения Клаузиуса – Клапейрона.
- •30) Гетерогенное равновесие. Бинарные системы. Законы Рауля. Законы Коновалова.
- •31) Основные понятия химической кинетики: скорость, механизм реакции.
- •32) Основной постулат химической кинетики. Гомогенные, гетерогенные реакции. Порядок и молекулярность реакции, отличая между ними.
- •33) Влияние концентрации на скорость химической реакции. Физический смысл, размерность константы скорости.
- •34) Кинетический анализ необратимых реакций первого порядка в закрытых системах.
- •35) Кинетический анализ необратимых реакций второго порядка в закрытых системах.
- •36) Кинетический анализ необратимых реакций нулевого порядка в закрытых системах.
- •37)Реакции 3-ого порядка
- •41. Влияние температуры на скорость химической реакции, правило Вант-Гоффа, закон Аррениуса.
- •42. Энергия активации, ее физический смысл. Методы определения энергии активации.
- •43.Катализ, основные свойства катализатора
- •44. Биогенные каталитические реакции. Кинетический анализ гомогенной каталитической реакции.
- •45. Электрохимия, особенности электрохимических реакций.
- •48. Приближения теории Дебая – Гюккеля, их концентрационные пределы применимости.
- •49) Основы теории электролитической диссоциации
- •50) Основные достоинства и недостатки тэд Аррениуса. Энергия кристаллической решетки, энергия сольватации.
- •51) Свойства буферных растворов, определение их рН, буферная емкость, диаграмма.
- •52) Определение рН гидратообразования и произведения растворимости гирооксидов металлов.
- •53. Удельная электропроводность растворов электролитов, зависимость от температуры и концентрации.
- •54. Молярная электропроводность. Закон Кольрауша. Определение молярной электропроводности при бесконечном разбавлении растворов сильных и электролитов.
- •55. Молярная электропроводность. Влияние температуры и концентрации на молярную электропроводность растворов сильных и слабых электролитов.
- •56. Электролиз, законы электролиза. Электролиз водных растворов солей с инертным анодом (привести пример).
- •57. Определение стандартного значения электродных потенциалов. Уравнение Нернста для определения эдс цепей.
- •58. Классификация электродов, правила записи электродов и цепей.
- •59.Химические цепи(гальванический элемент), их классификация.
- •60.Гальванический элемент. Термодинамика гальванического элемента.
17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
Термодинамическими потенциалами, или характеристическими функциями, называют термодинамические функции, посредством которых и их производных по соответствующим независимым переменным (естественным) могут быть выражены в явном виде все термодинамические свойства си-мы. Это означает, что характеристические функции содержат в себе всю термодинамическую информацию о си-ме. Наибольшее значение имеют четыре основных термодинамических потенциала (Пав):
1) внутренняя энергия U(S,V),
2)Энтальпия H(S,p)=U+pV,
3)энергия ГельмгольцаF(T,V)=U-TS,
4)энергия ГиббсаG(T,p)=H-TS=F+pV.
В скобках указаны естественные переменные для термодинамических потенциалов. Все эти потенциалы имеют размерность энергии и все они не имеют абсолютного значения, поскольку определены с точностью до постоянной, которая равна внутренней энергии при абсолютном нуле.
ϬQ=dU+ϬA, ϬA=pdV+ϬA', ϬQ=dU+pdV+δA' – первый закон термодинамики.
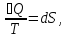 ϬQ=TdS
– второй закон термодинамики.
ϬQ=TdS
– второй закон термодинамики.
Зависимость термодинамических потенциалов от их естественных переменных описывается основным уравнением термодинамики, которое объединяет первое и второе начала: TdS=dU+ PdV=ϬA' => A'max= TdS-dU- PdV.
Рассмотрим максимальную работу при V=const, S=const: A'max= - dU- это и есть изохорно изоэнтропийный потенциал.
В данном случае A'max является функцией состояния, т.е не зависит от пути процесса. Величина A'max определяется уменьшением внутренней энергии си-мы.
A'max=-ПАВ- т.е во всех случаях A'max= убыли соответствующих термодинамических потенциалов.
A'max=-ПАВ- для обратимых процессов, A'max<-ПАВ- для необратимых процессов, A'max>=-ПАВ- для любых процессов.
A'max=0, т.е си-ма находится под влиянием давления.
∆ПАВ<0 при любом самопроизвольном процессе термодинамический потенциал уменьшается и его можно использовать, как критерий направления процесса:
Если процесс идет самопроизвольно прямо, тогда ПАВ уменьшается и процесс идет в прямом направлении.
Если ПАВ уменьшается и в момент равновесия имеет минимальные значения или ПАВ равно 0, тогда процесс идет в обоих направлениях.
Если ПАВ больше 0, то процесс идет в обратную сторону, т.е несамопроизвольно.
17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
Термодинамическими потенциалами, или характеристическими функциями, называют термодинамические функции, посредством которых и их производных по соответствующим независимым переменным (естественным) могут быть выражены в явном виде все термодинамические свойства си-мы. Это означает, что характеристические функции содержат в себе всю термодинамическую информацию о си-ме. Наибольшее значение имеют четыре основных термодинамических потенциала (Пав):
1) внутренняя энергия U(S,V),
2)Энтальпия H(S,p)=U+pV,
3)энергия ГельмгольцаF(T,V)=U-TS,
4)энергия ГиббсаG(T,p)=H-TS=F+pV.
В скобках указаны естественные переменные для термодинамических потенциалов. Все эти потенциалы имеют размерность энергии и все они не имеют абсолютного значения, поскольку определены с точностью до постоянной, которая равна внутренней энергии при абсолютном нуле.
ϬQ=dU+ϬA, ϬA=pdV+ϬA', ϬQ=dU+pdV+δA' – первый закон термодинамики.
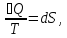 ϬQ=TdS
– второй закон термодинамики.
ϬQ=TdS
– второй закон термодинамики.
Зависимость термодинамических потенциалов от их естественных переменных описывается основным уравнением термодинамики, которое объединяет первое и второе начала: TdS=dU+ PdV=ϬA' => A'max= TdS-dU- PdV.
Рассмотрим максимальную работу при V=const, S=const: A'max= - dU- это и есть изохорно изоэнтропийный потенциал.
В данном случае A'max является функцией состояния, т.е не зависит от пути процесса. Величина A'max определяется уменьшением внутренней энергии си-мы.
A'max=-ПАВ- т.е во всех случаях A'max= убыли соответствующих термодинамических потенциалов.
A'max=-ПАВ- для обратимых процессов, A'max<-ПАВ- для необратимых процессов, A'max>=-ПАВ- для любых процессов.
A'max=0, т.е си-ма находится под влиянием давления.
∆ПАВ<0 при любом самопроизвольном процессе термодинамический потенциал уменьшается и его можно использовать, как критерий направления процесса:
Если процесс идет самопроизвольно прямо, тогда ПАВ уменьшается и процесс идет в прямом направлении.
Если ПАВ уменьшается и в момент равновесия имеет минимальные значения или ПАВ равно 0, тогда процесс идет в обоих направлениях.
Если ПАВ больше 0, то процесс идет в обратную сторону, т.е несамопроизвольно.
