
- •1. Физическая химия: цель, задачи, методы исследования. Основные понятия физической химии.
- •3 .Следствия первого начала термодинамики ( изохорный и изобарный процессы). Способы записи теплот химических реакций.
- •4. Закон Гесса, его следствия. Взаимосвязь между тепловым эффектом химической реакции при постоянном объеме и давлении.
- •7. Зависимость тепловых эффектов химических реакций от температуры. Уравнение Киргоффа. Определение реакции при нестандартной температуре.
- •9. Работа расширения для идеальных газов при адиабатическом процессе. Вывести уравнения адиабат.
- •11. II закон термодинамики для обратимых и необратимых процессов. Свойства энтропии.
- •12.Расчет изменения энтропии для различных физико-химических процессов: нагревание, фазовые переходы, смешение идеальных газов, изобарный, изотермический, изохорныйпроцессы.
- •13. Расчет изменения энтропии реакции при стандартной и нестандартной температурах (на примере реакций с участием неорганических веществ)
- •14.Изохорно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса.
- •15. Изобарно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •16) Изобарно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •18) Уравнение Гиббса – Гельмгольца. Определение изменения энергии Гиббса реакции при не стандартной температуре.
- •19) Химический потенциал, определение, условие равновесия в открытых системах. Химический потенциал идеальных и реальных систем (газы, растворы).
- •20) Химическое равновесие, вывод уравнения изотермы химической реакции. Определение стандартного значения константы равновесия реакций.
- •23) Влияние температуры на константу равновесия, вывод уравнения изобары Вант- Гоффа. Принцип Ле- Шателье.
- •25) Расчёт теп.Эф х.Р. На основе изобары Вант-Гоффа (расчётный и граф. Способы).
- •26) Расчёт теп.Эф х.Р. На основе изохоры Вант-Гоффа (расчётный и граф. Способы).
- •27)Фазовые равновесия основные опр-я:
- •28)Равновесие чис-го в-ва в 2-х фазах одноком.Сис-мы.
- •29) Определение теплоты спарение расчетным и графическим способами на основе уравнения Клаузиуса – Клапейрона.
- •30) Гетерогенное равновесие. Бинарные системы. Законы Рауля. Законы Коновалова.
- •31) Основные понятия химической кинетики: скорость, механизм реакции.
- •32) Основной постулат химической кинетики. Гомогенные, гетерогенные реакции. Порядок и молекулярность реакции, отличая между ними.
- •33) Влияние концентрации на скорость химической реакции. Физический смысл, размерность константы скорости.
- •34) Кинетический анализ необратимых реакций первого порядка в закрытых системах.
- •35) Кинетический анализ необратимых реакций второго порядка в закрытых системах.
- •36) Кинетический анализ необратимых реакций нулевого порядка в закрытых системах.
- •37)Реакции 3-ого порядка
- •41. Влияние температуры на скорость химической реакции, правило Вант-Гоффа, закон Аррениуса.
- •42. Энергия активации, ее физический смысл. Методы определения энергии активации.
- •43.Катализ, основные свойства катализатора
- •44. Биогенные каталитические реакции. Кинетический анализ гомогенной каталитической реакции.
- •45. Электрохимия, особенности электрохимических реакций.
- •48. Приближения теории Дебая – Гюккеля, их концентрационные пределы применимости.
- •49) Основы теории электролитической диссоциации
- •50) Основные достоинства и недостатки тэд Аррениуса. Энергия кристаллической решетки, энергия сольватации.
- •51) Свойства буферных растворов, определение их рН, буферная емкость, диаграмма.
- •52) Определение рН гидратообразования и произведения растворимости гирооксидов металлов.
- •53. Удельная электропроводность растворов электролитов, зависимость от температуры и концентрации.
- •54. Молярная электропроводность. Закон Кольрауша. Определение молярной электропроводности при бесконечном разбавлении растворов сильных и электролитов.
- •55. Молярная электропроводность. Влияние температуры и концентрации на молярную электропроводность растворов сильных и слабых электролитов.
- •56. Электролиз, законы электролиза. Электролиз водных растворов солей с инертным анодом (привести пример).
- •57. Определение стандартного значения электродных потенциалов. Уравнение Нернста для определения эдс цепей.
- •58. Классификация электродов, правила записи электродов и цепей.
- •59.Химические цепи(гальванический элемент), их классификация.
- •60.Гальванический элемент. Термодинамика гальванического элемента.
55. Молярная электропроводность. Влияние температуры и концентрации на молярную электропроводность растворов сильных и слабых электролитов.
Молярная
электропроводность
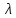 - электропроводность объема раствора
электролита, содержащего 1моль-экв
растворенного вещества и находящегося
между двумя параллельными электродами,
расположенными на расстоянии 1 метра
друг от друга. Удельная и молярная
электропроводности связаны между собой
соотношением:
- электропроводность объема раствора
электролита, содержащего 1моль-экв
растворенного вещества и находящегося
между двумя параллельными электродами,
расположенными на расстоянии 1 метра
друг от друга. Удельная и молярная
электропроводности связаны между собой
соотношением:
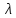 =
=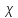 /Cm,
где Cm
– концентрация электролита, выраженная
в моль/м3.
Единица в молярной электропроводности
[
/Cm,
где Cm
– концентрация электролита, выраженная
в моль/м3.
Единица в молярной электропроводности
[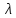 ]=См*см2*моль-1.
Для слабых электролитов:
]=См*см2*моль-1.
Для слабых электролитов:
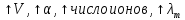 ,
,
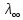 - полная
ионизация(
- полная
ионизация(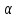 =1)
=1)
Для сильных электролитов:
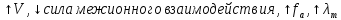
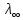 - полное
отсутствия межионного взаимодействия(
- полное
отсутствия межионного взаимодействия(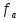 =1)
=1)
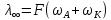
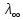 - молекулярная
электропроводность при таком сильном
разведении, когда слабые электролиты
полностью диссоциируют на ионы, а у
сильных – отсутствует межионное
взаимодействие.
- молекулярная
электропроводность при таком сильном
разведении, когда слабые электролиты
полностью диссоциируют на ионы, а у
сильных – отсутствует межионное
взаимодействие.
Зависимость молярной электропроводности от температуры можно представить уравнением:
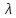 T=
T=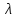 298[1+
298[1+ (T-298)],
где
(T-298)],
где
 T
и
T
и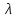 298
– молярные электропроводности при
температуре Т и 298К,
298
– молярные электропроводности при
температуре Т и 298К,
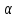 – температурный коэффициент
электропроводности. Для слабых
электролитов изменение молярной
электропроводности от концентрации
раствора связана в основном со степенью
диссоциации и для сильных электролитов
– с межионным взаимодействием.
Зависимость молярной электропроводности
от концентрации:
– температурный коэффициент
электропроводности. Для слабых
электролитов изменение молярной
электропроводности от концентрации
раствора связана в основном со степенью
диссоциации и для сильных электролитов
– с межионным взаимодействием.
Зависимость молярной электропроводности
от концентрации:
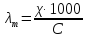 . Для сильных
электролитов
. Для сильных
электролитов
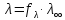 .
Таким образом, в растворах сильных
электролитов изменение молярной
электропроводности с концентрацией
обусловленной коэффициентом
электропроводности, то есть влиянием
электростатического взаимодействия
ионов на скорость их движения.
.
Таким образом, в растворах сильных
электролитов изменение молярной
электропроводности с концентрацией
обусловленной коэффициентом
электропроводности, то есть влиянием
электростатического взаимодействия
ионов на скорость их движения.
56. Электролиз, законы электролиза. Электролиз водных растворов солей с инертным анодом (привести пример).
Электролиз - окислительно-восстановительный процесс, протекающий под действием электрического тока.
Законы электролиза:
1 закон: масса вещества, выделившегося на электроде, прямо пропорциональна количеству электричества, пропущенного через раствор или расплав электролита.
2 закон: если через растворы нескольких электролитов пропустить одинаковое количество электричества, то массы выделившихся веществ будут прямо пропорциональны их электрохимическим эквивалентам.
57. Определение стандартного значения электродных потенциалов. Уравнение Нернста для определения эдс цепей.
Скачок электрического
потенциала между электродом, на котором
происходит окислительно-восстановительная
реакция, и раствором, устанавливающийся
при равенстве скоростей прямой и
обратной реакций, называется равновесным
потенциалом электрода в данном растворе.
Причина возникновения заряда на границе
металл-раствор является возникновение
двойного электрического слоя.В Общем
случае зависимость потенциала какого-либо
электрода от состава раствора и
температуры дается уравнением Нернста:
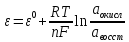 .
.
ЭДС элемента называется разность потенциалов на полюсах обратимого электрохимического элемента. ЭДС элемента измеряют при помощи компенсационного метода, которое заключается в том, что ЭДС вспомогательного нормального элемента сравнивается с неизвестной ЭДС. В качестве вспомогательного нормального элемента обычно применятся так называемый нормальный элемент Вестона. Этот элемент сохраняет длительное время постоянное и устойчивое значение ЭДС. ЭДС электрохимического элемента считается положительным, если электрохимическая цепь записана так, что катионы при работе элемента проходят в растворе от левого электрода к правому и в том же направлении движутся электроны по внешней цепи. При этом левый электрод является отрицательным, а правый – положительным.
