
- •1. Физическая химия: цель, задачи, методы исследования. Основные понятия физической химии.
- •3 .Следствия первого начала термодинамики ( изохорный и изобарный процессы). Способы записи теплот химических реакций.
- •4. Закон Гесса, его следствия. Взаимосвязь между тепловым эффектом химической реакции при постоянном объеме и давлении.
- •7. Зависимость тепловых эффектов химических реакций от температуры. Уравнение Киргоффа. Определение реакции при нестандартной температуре.
- •9. Работа расширения для идеальных газов при адиабатическом процессе. Вывести уравнения адиабат.
- •11. II закон термодинамики для обратимых и необратимых процессов. Свойства энтропии.
- •12.Расчет изменения энтропии для различных физико-химических процессов: нагревание, фазовые переходы, смешение идеальных газов, изобарный, изотермический, изохорныйпроцессы.
- •13. Расчет изменения энтропии реакции при стандартной и нестандартной температурах (на примере реакций с участием неорганических веществ)
- •14.Изохорно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса.
- •15. Изобарно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •16) Изобарно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •18) Уравнение Гиббса – Гельмгольца. Определение изменения энергии Гиббса реакции при не стандартной температуре.
- •19) Химический потенциал, определение, условие равновесия в открытых системах. Химический потенциал идеальных и реальных систем (газы, растворы).
- •20) Химическое равновесие, вывод уравнения изотермы химической реакции. Определение стандартного значения константы равновесия реакций.
- •23) Влияние температуры на константу равновесия, вывод уравнения изобары Вант- Гоффа. Принцип Ле- Шателье.
- •25) Расчёт теп.Эф х.Р. На основе изобары Вант-Гоффа (расчётный и граф. Способы).
- •26) Расчёт теп.Эф х.Р. На основе изохоры Вант-Гоффа (расчётный и граф. Способы).
- •27)Фазовые равновесия основные опр-я:
- •28)Равновесие чис-го в-ва в 2-х фазах одноком.Сис-мы.
- •29) Определение теплоты спарение расчетным и графическим способами на основе уравнения Клаузиуса – Клапейрона.
- •30) Гетерогенное равновесие. Бинарные системы. Законы Рауля. Законы Коновалова.
- •31) Основные понятия химической кинетики: скорость, механизм реакции.
- •32) Основной постулат химической кинетики. Гомогенные, гетерогенные реакции. Порядок и молекулярность реакции, отличая между ними.
- •33) Влияние концентрации на скорость химической реакции. Физический смысл, размерность константы скорости.
- •34) Кинетический анализ необратимых реакций первого порядка в закрытых системах.
- •35) Кинетический анализ необратимых реакций второго порядка в закрытых системах.
- •36) Кинетический анализ необратимых реакций нулевого порядка в закрытых системах.
- •37)Реакции 3-ого порядка
- •41. Влияние температуры на скорость химической реакции, правило Вант-Гоффа, закон Аррениуса.
- •42. Энергия активации, ее физический смысл. Методы определения энергии активации.
- •43.Катализ, основные свойства катализатора
- •44. Биогенные каталитические реакции. Кинетический анализ гомогенной каталитической реакции.
- •45. Электрохимия, особенности электрохимических реакций.
- •48. Приближения теории Дебая – Гюккеля, их концентрационные пределы применимости.
- •49) Основы теории электролитической диссоциации
- •50) Основные достоинства и недостатки тэд Аррениуса. Энергия кристаллической решетки, энергия сольватации.
- •51) Свойства буферных растворов, определение их рН, буферная емкость, диаграмма.
- •52) Определение рН гидратообразования и произведения растворимости гирооксидов металлов.
- •53. Удельная электропроводность растворов электролитов, зависимость от температуры и концентрации.
- •54. Молярная электропроводность. Закон Кольрауша. Определение молярной электропроводности при бесконечном разбавлении растворов сильных и электролитов.
- •55. Молярная электропроводность. Влияние температуры и концентрации на молярную электропроводность растворов сильных и слабых электролитов.
- •56. Электролиз, законы электролиза. Электролиз водных растворов солей с инертным анодом (привести пример).
- •57. Определение стандартного значения электродных потенциалов. Уравнение Нернста для определения эдс цепей.
- •58. Классификация электродов, правила записи электродов и цепей.
- •59.Химические цепи(гальванический элемент), их классификация.
- •60.Гальванический элемент. Термодинамика гальванического элемента.
11. II закон термодинамики для обратимых и необратимых процессов. Свойства энтропии.
Термодинамика (греч. термо - «тепло», динамика - «сила») - раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. В отдельные дисциплины выделились химическая термодинамика, изучающая физико-химические превращения, связанные с выделением или поглощением тепла, а также теплотехника.
II
закон термодинамики для обратимых
процессов. Найдем зависимость функции
состояния энтропии от теплоты для
обратимых процессов. Запишем уравнение
первого начала термодинамики для
процесса с бесконечно малыми изменениями
параметров:
 Если процесс обратимый и совершается
только механическая работа против сил
внешнего давления, то
Если процесс обратимый и совершается
только механическая работа против сил
внешнего давления, то Рассмотрим
1моль идеального газа. Учитывая, что
Рассмотрим
1моль идеального газа. Учитывая, что
 ,
можно записать уравнение (1) в виде:
,
можно записать уравнение (1) в виде: Если для идеального газа
Если для идеального газа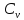 не зависит от объема, получим
не зависит от объема, получим из
уравнения состояния идеального газа
из
уравнения состояния идеального газа
 находим
находим
 и
и
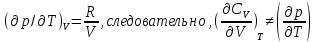 (4).
(4).
Таким
образом
 не является полным дифференциалом. На
примере идеального газа докажем, что
если обе части равенства (3) разделив
на Т, то
не является полным дифференциалом. На
примере идеального газа докажем, что
если обе части равенства (3) разделив
на Т, то приобретает свойства полного
дифференциала. Для идеального газа из
соотношения
приобретает свойства полного
дифференциала. Для идеального газа из
соотношения имеем:
имеем:

Тогда
уравнение (3) для одного моля газа примет
вид:
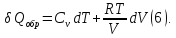
Разделив
обе части уравнения (6) на Т, олучим:
 где
где
 теплота.
Из уравнения видно, что:
теплота.
Из уравнения видно, что:

Уравнение
(8) справедливо не только для идеального
газа, но для любой системы. Из этого
уравнения следует, что для всех систем:
 .
Уравнение (9) представляет собой
математическую формулировку второго
начала термодинамики для обратимых
процессов. В любых круговых процессах
изменение энтропии, как и любых других
функций состояния, равно нулю:
.
Уравнение (9) представляет собой
математическую формулировку второго
начала термодинамики для обратимых
процессов. В любых круговых процессах
изменение энтропии, как и любых других
функций состояния, равно нулю: Отсюда
в соответствии с уравнением (9):
Отсюда
в соответствии с уравнением (9):
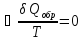 ;
(10).
;
(10).
Математическая
формулировка второго начала термодинамики
для обратимых процессов. Пусть из
состояния 1 в состояние 2 система может
перейти как посредством необратимого
процесса, так и обратимого (рисунок).
Согласно первому началу термодинамики
для необратимого процесса получаем:
 а для обратимого процесса:
а для обратимого процесса:
 (12).
Вычитая из (11)
уравнение (12),
получим для кругового процесса:
(12).
Вычитая из (11)
уравнение (12),
получим для кругового процесса:

Выражение (13) может быть равно нулю, больше нуля. Если оба процесса обраимы, то уравнение равно нулю, так как после проведения обратимого процесса в прямом и обратном направлениях никаких изменений в самой системе, ни в окружающей среде не происходит. Если обе части равенства больше нуля, то это означает, что единственным результатом кругового процесса будет поглощение теплоты из окружающей среды и совершение системой эквивалентного количества работы, т.е. полное превращение теплоты в работу, что противоречит второму началу термодинамики. Если обе разности в уравнении (13) меньше нуля, то это не противоречит второму началу термодинамики, потому что единственным результатом будет полное превращение работы в теплоту. Таким образом, непосредственным следсвием второго начала термодинамики и определения необратимых процессов являются два неравенства:


Из (15)
следует, что работа любого необратимого
процесса всегда меньше работы обратимого
процесса между теми же начальными и
конечными состояниями сиситемы. Потому
работу в обратимых процессах называют
максимальной работой:

Чем меньше работа
по сравнению с максимальной6 тем более
необратим процесс.
Процессы, которые происходят без
совершения работы, называются
необратимыми. Найдем соотношение между
изменением энтропии и теплотой,
передаваемой в необратимом процессе.
Теплота в необратимом процессе согласно
уравнению (14)
меньше чем в обратимом. При этом из
уравнения (9)
получаем:
 или
или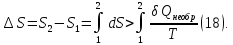 Для необратимых самопроихвольных
процессов в изолированной системе
Для необратимых самопроихвольных
процессов в изолированной системе и из (17)
получаем:
и из (17)
получаем:
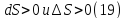 .
При изотермических необратимых процессах
(T=const)
.
При изотермических необратимых процессах
(T=const)
 .
.
Для цикллов, включающих необратимые процессы, из (17) и (10) получаем соотношение:

Уравнения
(17)
– (21)
представляют собой выражения второго
начала термодинамики для необратимых
процессов. Для необратимых процессов
второе начало термодинамики – это
закон существования и возрастания
энтропии. Как следует из уравнения
(19),
при протекании необратимого процесса
в изолированной системе энтропия
возрастает. Объединяя соотношения (17)
и
(9)
выражающие второй закон термодинамики
для обратимых и необратимых процессов,
можно записать:
 Знак
равенства соответствует обратимым
процессам, знак неравенства – необратимым.
Для изолированных систем
Знак
равенства соответствует обратимым
процессам, знак неравенства – необратимым.
Для изолированных систем и из неравенства (20) получим:
и из неравенства (20) получим:
Полставляя
в уравнение (23)
значение
 из
соотношения
из
соотношения
 получим
объединенное уравнение первого и
второго начала термодинамики:
получим
объединенное уравнение первого и
второго начала термодинамики:

