
- •1. Физическая химия: цель, задачи, методы исследования. Основные понятия физической химии.
- •3 .Следствия первого начала термодинамики ( изохорный и изобарный процессы). Способы записи теплот химических реакций.
- •4. Закон Гесса, его следствия. Взаимосвязь между тепловым эффектом химической реакции при постоянном объеме и давлении.
- •7. Зависимость тепловых эффектов химических реакций от температуры. Уравнение Киргоффа. Определение реакции при нестандартной температуре.
- •9. Работа расширения для идеальных газов при адиабатическом процессе. Вывести уравнения адиабат.
- •11. II закон термодинамики для обратимых и необратимых процессов. Свойства энтропии.
- •12.Расчет изменения энтропии для различных физико-химических процессов: нагревание, фазовые переходы, смешение идеальных газов, изобарный, изотермический, изохорныйпроцессы.
- •13. Расчет изменения энтропии реакции при стандартной и нестандартной температурах (на примере реакций с участием неорганических веществ)
- •14.Изохорно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса.
- •15. Изобарно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •16) Изобарно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •18) Уравнение Гиббса – Гельмгольца. Определение изменения энергии Гиббса реакции при не стандартной температуре.
- •19) Химический потенциал, определение, условие равновесия в открытых системах. Химический потенциал идеальных и реальных систем (газы, растворы).
- •20) Химическое равновесие, вывод уравнения изотермы химической реакции. Определение стандартного значения константы равновесия реакций.
- •23) Влияние температуры на константу равновесия, вывод уравнения изобары Вант- Гоффа. Принцип Ле- Шателье.
- •25) Расчёт теп.Эф х.Р. На основе изобары Вант-Гоффа (расчётный и граф. Способы).
- •26) Расчёт теп.Эф х.Р. На основе изохоры Вант-Гоффа (расчётный и граф. Способы).
- •27)Фазовые равновесия основные опр-я:
- •28)Равновесие чис-го в-ва в 2-х фазах одноком.Сис-мы.
- •29) Определение теплоты спарение расчетным и графическим способами на основе уравнения Клаузиуса – Клапейрона.
- •30) Гетерогенное равновесие. Бинарные системы. Законы Рауля. Законы Коновалова.
- •31) Основные понятия химической кинетики: скорость, механизм реакции.
- •32) Основной постулат химической кинетики. Гомогенные, гетерогенные реакции. Порядок и молекулярность реакции, отличая между ними.
- •33) Влияние концентрации на скорость химической реакции. Физический смысл, размерность константы скорости.
- •34) Кинетический анализ необратимых реакций первого порядка в закрытых системах.
- •35) Кинетический анализ необратимых реакций второго порядка в закрытых системах.
- •36) Кинетический анализ необратимых реакций нулевого порядка в закрытых системах.
- •37)Реакции 3-ого порядка
- •41. Влияние температуры на скорость химической реакции, правило Вант-Гоффа, закон Аррениуса.
- •42. Энергия активации, ее физический смысл. Методы определения энергии активации.
- •43.Катализ, основные свойства катализатора
- •44. Биогенные каталитические реакции. Кинетический анализ гомогенной каталитической реакции.
- •45. Электрохимия, особенности электрохимических реакций.
- •48. Приближения теории Дебая – Гюккеля, их концентрационные пределы применимости.
- •49) Основы теории электролитической диссоциации
- •50) Основные достоинства и недостатки тэд Аррениуса. Энергия кристаллической решетки, энергия сольватации.
- •51) Свойства буферных растворов, определение их рН, буферная емкость, диаграмма.
- •52) Определение рН гидратообразования и произведения растворимости гирооксидов металлов.
- •53. Удельная электропроводность растворов электролитов, зависимость от температуры и концентрации.
- •54. Молярная электропроводность. Закон Кольрауша. Определение молярной электропроводности при бесконечном разбавлении растворов сильных и электролитов.
- •55. Молярная электропроводность. Влияние температуры и концентрации на молярную электропроводность растворов сильных и слабых электролитов.
- •56. Электролиз, законы электролиза. Электролиз водных растворов солей с инертным анодом (привести пример).
- •57. Определение стандартного значения электродных потенциалов. Уравнение Нернста для определения эдс цепей.
- •58. Классификация электродов, правила записи электродов и цепей.
- •59.Химические цепи(гальванический элемент), их классификация.
- •60.Гальванический элемент. Термодинамика гальванического элемента.
12.Расчет изменения энтропии для различных физико-химических процессов: нагревание, фазовые переходы, смешение идеальных газов, изобарный, изотермический, изохорныйпроцессы.
Термодинамика (греч. термо - «тепло», динамика - «сила») - раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. В отдельные дисциплины выделились химическая термодинамика, изучающая физико-химические превращения, связанные с выделением или поглощением тепла, а также теплотехника.
Энтропия – величина экстенсивная; она зависит от количества вещества в системе. Энтропия подчиняется закону аддитивности, т.е. энтропия равновесной системы равна сумме энтропий отдельных ее частей, а изменение энтропии всей системы равно сумме изменений энтропии ее частей. Изменение энтропии в сложном процессе равно сумме изменений энтропии в отдельных стадиях процесса. Для необратимых процессов изменение энтропии связано с теплотой процесса неравенствами. Поэтому по данным для необратимых процессов энтропию нельзя вычислить. Но изменение энтропии в обратимом и необратимом процессах одинаково, так как энтропия является функцией состояния. Следовательно, чтобы вычислить изменение энтропии в данном реальном необратимом процессе, нужно этот процесс разбить на стадии, которые проводятся обратимо, и вычислить для них изменения энтропии по уравнениям для обратимых процессов. Просуммировав изменения энтропии всех стадий, получим изменение энтропии в необратимом процессе.
Вычислим изменение энтропии для разнчх процессов:
1.Для
изотермического процесса (Т=const)
с
любым веществом. Проведем мысленно
данный изотермический процесс обратимо
и рассчитаем изменение энтропии по
уравнению
 Например, для фазового перехода
Например, для фазового перехода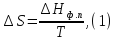 где
где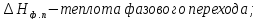 Т – абсолютная температура фазового
перехода. В общем случае обратимого
процесса при постоянном объеме, когда
изменение внутренней энергии равно
Т – абсолютная температура фазового
перехода. В общем случае обратимого
процесса при постоянном объеме, когда
изменение внутренней энергии равно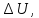 или при постоянном давлении, когда
изменение энтальпии равно
или при постоянном давлении, когда
изменение энтальпии равно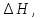 изменение энтропии равно:
изменение энтропии равно: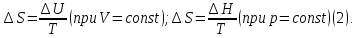
2.
При нагревании любого вещества от
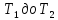 при
постоянном объеме (V=const).
В
случае, как следует из математической
формулироквки первого начала
термодинамики, теплота процесса
приобретает свойства функции состояния
и не зависит от пути процесса. Подставляя
значение
при
постоянном объеме (V=const).
В
случае, как следует из математической
формулироквки первого начала
термодинамики, теплота процесса
приобретает свойства функции состояния
и не зависит от пути процесса. Подставляя
значение
 из уравнения
из уравнения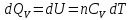 и
и
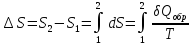 , получаем:
, получаем:
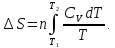 Если
принять
Если
принять
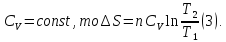
3. При нагревании любого вещества при постоянном давлении (p=const)
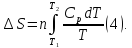 При
При
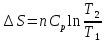 (4)
(4)
4.Для
различных процессов с идеальным газом
в соответствии с
 получим
выражение
получим
выражение
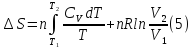
Если
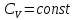 ,
вместо
уравнения (5) можно написать
,
вместо
уравнения (5) можно написать
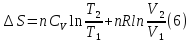
Учитывая,
что для идеального газа
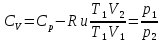 ,
уравнение (6) можно представить в виде:
,
уравнение (6) можно представить в виде: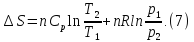
В
изотермическом процессе, учитывая, что
 получаем
из (6) и (7)
получаем
из (6) и (7)
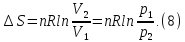
В
изохорном процессе, учитывая, что
 получаем из равенства (6)
получаем из равенства (6)
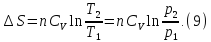
В
изобарном процессе, учитывая, что
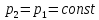 и
и
 находим
из (7)
находим
из (7)
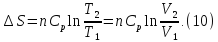
Определим
изменение энтропии при взаимной диффузии
двух идеальных газов. Представим себе
два идеальных газа (1 и 2), находящихся
в сосуде, разделенном перегородкой с
отверстием. Пусть вначале в одной части
сосуда объемом
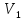 находится
находится
 молей газа 1-го сорта, а в другой части
сосуда объемом
молей газа 1-го сорта, а в другой части
сосуда объемом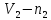 молей
газа 2-го сорта, причем, давлениеp
и температура Т обоих газов одинаковы.
Газы будут взаимно диффундировать
через отверстие в перегородке и через
некоторое время в обеих частях сосуда
образуется равномерная смесь газов;
при этом
молей
газа 2-го сорта, причем, давлениеp
и температура Т обоих газов одинаковы.
Газы будут взаимно диффундировать
через отверстие в перегородке и через
некоторое время в обеих частях сосуда
образуется равномерная смесь газов;
при этом
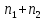 молей газов займут весь объем
молей газов займут весь объем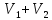 сосуда.
сосуда.
