
- •1. Физическая химия: цель, задачи, методы исследования. Основные понятия физической химии.
- •3 .Следствия первого начала термодинамики ( изохорный и изобарный процессы). Способы записи теплот химических реакций.
- •4. Закон Гесса, его следствия. Взаимосвязь между тепловым эффектом химической реакции при постоянном объеме и давлении.
- •7. Зависимость тепловых эффектов химических реакций от температуры. Уравнение Киргоффа. Определение реакции при нестандартной температуре.
- •9. Работа расширения для идеальных газов при адиабатическом процессе. Вывести уравнения адиабат.
- •11. II закон термодинамики для обратимых и необратимых процессов. Свойства энтропии.
- •12.Расчет изменения энтропии для различных физико-химических процессов: нагревание, фазовые переходы, смешение идеальных газов, изобарный, изотермический, изохорныйпроцессы.
- •13. Расчет изменения энтропии реакции при стандартной и нестандартной температурах (на примере реакций с участием неорганических веществ)
- •14.Изохорно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса.
- •15. Изобарно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •16) Изобарно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •18) Уравнение Гиббса – Гельмгольца. Определение изменения энергии Гиббса реакции при не стандартной температуре.
- •19) Химический потенциал, определение, условие равновесия в открытых системах. Химический потенциал идеальных и реальных систем (газы, растворы).
- •20) Химическое равновесие, вывод уравнения изотермы химической реакции. Определение стандартного значения константы равновесия реакций.
- •23) Влияние температуры на константу равновесия, вывод уравнения изобары Вант- Гоффа. Принцип Ле- Шателье.
- •25) Расчёт теп.Эф х.Р. На основе изобары Вант-Гоффа (расчётный и граф. Способы).
- •26) Расчёт теп.Эф х.Р. На основе изохоры Вант-Гоффа (расчётный и граф. Способы).
- •27)Фазовые равновесия основные опр-я:
- •28)Равновесие чис-го в-ва в 2-х фазах одноком.Сис-мы.
- •29) Определение теплоты спарение расчетным и графическим способами на основе уравнения Клаузиуса – Клапейрона.
- •30) Гетерогенное равновесие. Бинарные системы. Законы Рауля. Законы Коновалова.
- •31) Основные понятия химической кинетики: скорость, механизм реакции.
- •32) Основной постулат химической кинетики. Гомогенные, гетерогенные реакции. Порядок и молекулярность реакции, отличая между ними.
- •33) Влияние концентрации на скорость химической реакции. Физический смысл, размерность константы скорости.
- •34) Кинетический анализ необратимых реакций первого порядка в закрытых системах.
- •35) Кинетический анализ необратимых реакций второго порядка в закрытых системах.
- •36) Кинетический анализ необратимых реакций нулевого порядка в закрытых системах.
- •37)Реакции 3-ого порядка
- •41. Влияние температуры на скорость химической реакции, правило Вант-Гоффа, закон Аррениуса.
- •42. Энергия активации, ее физический смысл. Методы определения энергии активации.
- •43.Катализ, основные свойства катализатора
- •44. Биогенные каталитические реакции. Кинетический анализ гомогенной каталитической реакции.
- •45. Электрохимия, особенности электрохимических реакций.
- •48. Приближения теории Дебая – Гюккеля, их концентрационные пределы применимости.
- •49) Основы теории электролитической диссоциации
- •50) Основные достоинства и недостатки тэд Аррениуса. Энергия кристаллической решетки, энергия сольватации.
- •51) Свойства буферных растворов, определение их рН, буферная емкость, диаграмма.
- •52) Определение рН гидратообразования и произведения растворимости гирооксидов металлов.
- •53. Удельная электропроводность растворов электролитов, зависимость от температуры и концентрации.
- •54. Молярная электропроводность. Закон Кольрауша. Определение молярной электропроводности при бесконечном разбавлении растворов сильных и электролитов.
- •55. Молярная электропроводность. Влияние температуры и концентрации на молярную электропроводность растворов сильных и слабых электролитов.
- •56. Электролиз, законы электролиза. Электролиз водных растворов солей с инертным анодом (привести пример).
- •57. Определение стандартного значения электродных потенциалов. Уравнение Нернста для определения эдс цепей.
- •58. Классификация электродов, правила записи электродов и цепей.
- •59.Химические цепи(гальванический элемент), их классификация.
- •60.Гальванический элемент. Термодинамика гальванического элемента.
33) Влияние концентрации на скорость химической реакции. Физический смысл, размерность константы скорости.
Химическая кинетика - это учение о скорости и механизме процесса и его зависимости от различных факторов, позволяющих ускорить или замедлить ход реакции.
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций):
Vгом = Δn/VΔt = ± ΔC/Δt; Vгетер = Δn/SΔt
Это выражение используют со знаком «+», если скорость определяется по образующемуся в реакции веществу, в противном случае со знаком «-». Т.о. скорость реакции всегда положительна.
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Средняя скорость в промежутке времени Δt:
![]()
В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
![]()
Графики: а) кинетические кривые для исходных веществ (А) и продуктов реакции (В);
б) графическое определение истинной скорости.
![]()
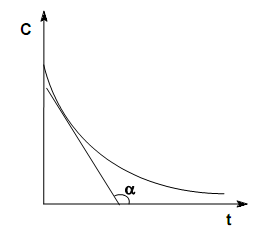
а) б)
Для реакции в общем виде скорость химической реакции с учетом стехиометрических коэффициентов:
aA + bB = cC + dD
Vt = -dCA/dt = -dCB/dt = -dCC/dt = dCD/dt
Закон действующих масс: скорость простой реакции при постоянной температуре прямо пропорциональна произведению концентраций реагентов в степени их стехиометрических коэффициентов.
Этим правилом и определяется влияние концентрации на скорость реакции. Оно было выражено (в несколько иной форме) впервые Гульдбергом и Вааге (1867).
Для простой реакции:
aA + bB = cC + dD
математическое выражение ЗДМ:
V = kCAaCBb,
где V – скорость реакции;
k – константа скорости реакции;
СА и СВ – молярные концентрации реагентов;
a и b – кинетический порядок реакции по веществу А и В соответственно.
В общем случае:
aA + bB + dD +………..
V = kCAaCBbCDd……….
Скорость химической реакции, проводимой без добавления реагентов извне, максимальна в начале(кон-ции реагентов max ) и минимальна в конце (конц-я реагентов min)
Размерность V: V = [моль/(л•с)] = [моль/(м3•мин)]
Константа скорости реакции.
Коэффициент пропорциональности k есть константа скорости химической реакции. Физический смысл k вытекает из уравнения V = kCAaCBb .Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Константа при постоянной t0 зависит только от природы веществ и не зависит от их концентрации.
Размерность k: n =0, [k] = [ моль/л•с]
n = 1, [k] = [1/с]
Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (соответственно a, b и c) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (a + b + c) представляет собой общий порядок реакции. Порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
