
- •1. Физическая химия: цель, задачи, методы исследования. Основные понятия физической химии.
- •3 .Следствия первого начала термодинамики ( изохорный и изобарный процессы). Способы записи теплот химических реакций.
- •4. Закон Гесса, его следствия. Взаимосвязь между тепловым эффектом химической реакции при постоянном объеме и давлении.
- •7. Зависимость тепловых эффектов химических реакций от температуры. Уравнение Киргоффа. Определение реакции при нестандартной температуре.
- •9. Работа расширения для идеальных газов при адиабатическом процессе. Вывести уравнения адиабат.
- •11. II закон термодинамики для обратимых и необратимых процессов. Свойства энтропии.
- •12.Расчет изменения энтропии для различных физико-химических процессов: нагревание, фазовые переходы, смешение идеальных газов, изобарный, изотермический, изохорныйпроцессы.
- •13. Расчет изменения энтропии реакции при стандартной и нестандартной температурах (на примере реакций с участием неорганических веществ)
- •14.Изохорно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса.
- •15. Изобарно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •16) Изобарно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •18) Уравнение Гиббса – Гельмгольца. Определение изменения энергии Гиббса реакции при не стандартной температуре.
- •19) Химический потенциал, определение, условие равновесия в открытых системах. Химический потенциал идеальных и реальных систем (газы, растворы).
- •20) Химическое равновесие, вывод уравнения изотермы химической реакции. Определение стандартного значения константы равновесия реакций.
- •23) Влияние температуры на константу равновесия, вывод уравнения изобары Вант- Гоффа. Принцип Ле- Шателье.
- •25) Расчёт теп.Эф х.Р. На основе изобары Вант-Гоффа (расчётный и граф. Способы).
- •26) Расчёт теп.Эф х.Р. На основе изохоры Вант-Гоффа (расчётный и граф. Способы).
- •27)Фазовые равновесия основные опр-я:
- •28)Равновесие чис-го в-ва в 2-х фазах одноком.Сис-мы.
- •29) Определение теплоты спарение расчетным и графическим способами на основе уравнения Клаузиуса – Клапейрона.
- •30) Гетерогенное равновесие. Бинарные системы. Законы Рауля. Законы Коновалова.
- •31) Основные понятия химической кинетики: скорость, механизм реакции.
- •32) Основной постулат химической кинетики. Гомогенные, гетерогенные реакции. Порядок и молекулярность реакции, отличая между ними.
- •33) Влияние концентрации на скорость химической реакции. Физический смысл, размерность константы скорости.
- •34) Кинетический анализ необратимых реакций первого порядка в закрытых системах.
- •35) Кинетический анализ необратимых реакций второго порядка в закрытых системах.
- •36) Кинетический анализ необратимых реакций нулевого порядка в закрытых системах.
- •37)Реакции 3-ого порядка
- •41. Влияние температуры на скорость химической реакции, правило Вант-Гоффа, закон Аррениуса.
- •42. Энергия активации, ее физический смысл. Методы определения энергии активации.
- •43.Катализ, основные свойства катализатора
- •44. Биогенные каталитические реакции. Кинетический анализ гомогенной каталитической реакции.
- •45. Электрохимия, особенности электрохимических реакций.
- •48. Приближения теории Дебая – Гюккеля, их концентрационные пределы применимости.
- •49) Основы теории электролитической диссоциации
- •50) Основные достоинства и недостатки тэд Аррениуса. Энергия кристаллической решетки, энергия сольватации.
- •51) Свойства буферных растворов, определение их рН, буферная емкость, диаграмма.
- •52) Определение рН гидратообразования и произведения растворимости гирооксидов металлов.
- •53. Удельная электропроводность растворов электролитов, зависимость от температуры и концентрации.
- •54. Молярная электропроводность. Закон Кольрауша. Определение молярной электропроводности при бесконечном разбавлении растворов сильных и электролитов.
- •55. Молярная электропроводность. Влияние температуры и концентрации на молярную электропроводность растворов сильных и слабых электролитов.
- •56. Электролиз, законы электролиза. Электролиз водных растворов солей с инертным анодом (привести пример).
- •57. Определение стандартного значения электродных потенциалов. Уравнение Нернста для определения эдс цепей.
- •58. Классификация электродов, правила записи электродов и цепей.
- •59.Химические цепи(гальванический элемент), их классификация.
- •60.Гальванический элемент. Термодинамика гальванического элемента.
58. Классификация электродов, правила записи электродов и цепей.
В зависимости от природы электродной реакции различают несколько типов электродов.
1)Электроды 1го рода. Электродом первого рода называют металл или неметалл, погруженный в раствор, содержащий его ионы. Электрод первого рода можно представить в виде схемы: Мz+ |М.
Ему отвечает электродная реакция: Мz+ + zе = М.
Потенциал электрода первого рода можно записать:
 ,
,
Где
 - активность ионов металла в растворе.
Активность атомов в электроде из чистого
металла принимается равной единице.
Примером электрода 1 рода может служить
медный электрод в растворе соли меди.
К неметаллическим электродам первого
рода относят селеновый электрод.
- активность ионов металла в растворе.
Активность атомов в электроде из чистого
металла принимается равной единице.
Примером электрода 1 рода может служить
медный электрод в растворе соли меди.
К неметаллическим электродам первого
рода относят селеновый электрод.
2)Электроды 2 рода. Электрод второго рода состоит из металла, покрытого слоем его малорастворимого соединения и погруженного в раствор растворимой соли, содержащий тот же анион, что и малорастворимое соединение. Электрод второго рода и протекающая на нем электродная реакция записывается в виде схемы: Аz-|MA, M.
Реакцию можно
записать: MA
+ ze
 M
+ Az-.
M
+ Az-.
Потенциал электрода второго рода можно представить выражением:
 ,
,
Электроды второго рода широко применяются в электрохимических измерениях в качестве электродов сравнения, так как их потенциал устойчив во времени и хорошо воспроизводится. Примерами электрода второго рода могут служить каломельный и хлорсеребряный электроды.
3)Газовые
электроды.
Газовый электрод состоит из инертного
металла(обычно платины), контактирующего
одновременно с газом и раствором,
содержащим ионы этого газообразного
вещества. Примерами газовых электродов
могут служить водородный, кислородный
и хлорный электроды. Газовые электроды
иногда относят к электродам первого
рода. Водородный электрод записывается
в виде схемы: H+|H2,Pt
и протекающая на нем реакция в виде H+
+ e
= 1/2H2.
Содержание газообразного вещества,
участвующего в электродной реакции,
принято выражать в единицах давления
чистого газа или его парциального
давления в газовой смеси. Потенциал
водородного электрода описывается
уравнением:
 .
.
4)Амальгамные
электроды.
Амальгамный электрод состоит из
амальгамы данного металла в контакте
с раствором, содержащим ионы этого
металла. Амальгамный электрод можно
представить схемой: Mz+|M,Hg.
Ему отвечает электродная реакция Mz+
+ ze
= M(Hg).
Потенциал амальгамного электрода:
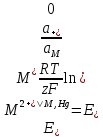 ,
где
,
где и
и - активности ионов металла соответственно
в водном растворе и амальгаме.
- активности ионов металла соответственно
в водном растворе и амальгаме.
5)Окислительно-восстановительные
электроды.
Этот электрод состоит из инертного
металла, погруженного в раствор,
содержащий окисленную и восстановленную
формы вещества. Различают простые и
сложные окислительно-восстановительные
системы. В простой окислительно-восстановительной
системе электродная реакция состоит
в изменении заряда ионов: O,R|Pt
O
+ ze
= R.
Примером сложный окислительно-восстановительной
системы может служить система из ионов
Mn и Mn2+.
и Mn2+.
59.Химические цепи(гальванический элемент), их классификация.
Гальванические элементы подразделяются на три большие группы: физические, химические и концентрационные.
Физические цепи – в них электроды отличаются друг от друга только физическими свойствами. Это могут быть различные модификации одного и того металла, но в разных формах устойчивости. Источником электрической энергии физических цепей служит свободная энергия перехода электрона из менее устойчивого в более устойчивое состояния.
В химических цепях электроды отличаются друг от друга химическими свойствами. В этих цепях источником электрической энергии служит химическая реакция. Различают химические цепи с двумя и одним электролитом. К электрохимическим элементам с двумя электролитами относятся элемент Даниэля-Якоби. Химические цепи с одним электролитом могут быть двух видов. В цепях первого вида на одном электроде протекает реакция с участием катиона электролита, а на другом электроде с участием аниона электролита. В элементах второго вида с одним электролитом на обоих электродах протекают реакции с участием аниона электролита; при этом один электрод – газовый, а в другой – второго рода. Химические цепи с одним электролитом широко применяются в физико-химических исследованиях.
Концентрационные цепи. Концентрационными цепями называют те цепи, в которых оба электрода одинаковы по своей природе, но различаются активностью одного или нескольких участников электродной реакции. При этом электрическая энергия получается за счет выравнивания концентрации веществ в элементе. Концентрационные цепи могут быть без переноса и с переносом. Концентрационными цепями без переноса называются элементы: а)с одинаковыми электродами и двумя одинаковыми по природе, но разными по концентрации растворами электролитов. Б) с электродами из двух сплавов (амальгам), одинаковых по природе, но разных по концентрации; в)с газовыми электродами, одинаковыми по природе, но с разным давлением газа на электродах.
Концентрационными цепями с переносом называются элементы с одинаковыми электродами и двумя одинаковыми по природе, но разными по концентрации растворами электролитов.
