
77
.pdfКАЗАНСКАЯ ГОСУДАРСТВЕННАЯ АРХИТЕКТУРНО-СТРОИТЕЛЬНАЯ АКАДЕМИЯ
_________________________________________________________
Кафедра физики
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЛАБОРАТОРНЫМ РАБОТАМ ПО ФИЗИКЕ
для студентов специальностей
2903, 2906, 2907, 2908, 2910
Лабораторная работа № 77
ПРОВЕРКА ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИКИ НА ОСНОВЕ КОМПЬЮТЕРНОГО МОДЕЛИРОВАНИЯ ФИЗИЧЕСКИХ ПРОЦЕССОВ
Казань – 2000 г.
1
Составитель: В.В. Алексеев Под редакцией Л.И. Маклакова
УДК 539.15
Методические указания к лабораторным работам по физике для студентов дневного и заочного отделений специальностей 2903, 2906, 2907, 2908, 2910/ Казанская государственная архитектурно-строитель-ная академия; Сост. В.И. Сундуков. Под редакцией В.В. Алексеева, Л.И. Маклакова. Казань, 2000 г.
11с.
Вработе рассматриваются вопросы термодинамики. Приводятся теоретиче- ский и практический способы определения моментов инерции диска.
Ил. 3. Табл. 1.
Рецензент профессор кафедры молекулярной физики Казанского госуни- верситета Скирда В.Д.
ã Казанская государственная архитектурно-строительная академия, 2000 г.
2
Целью данной работы является изучение термодинамических процессов в газах и проверка справедливости первого закона термодинамики с помощью математического моделирования процессов на компьютере. Математическое моделирование - метод исследования физических явлений с помощью специ- альных моделей, основанный на идентичности математического описания про- цессов в оригинале и модели. В данной работе моделируются два термодина- мических процесса, происходящих в идеальном газе.
Основные понятия термодинамики.
Термодинамика - наука, изучающая тепловые свойства систем без рас- смотрения их внутреннего строения. Она лежит в основе работы тепловых дви- гателей, широко использующихся на практике. Важную роль при этом играют различные процессы, происходящие в газах, или, говоря в общем, в термодина- мической системе. Термодинамической системой называют совокупность большого числа молекул, атомов, или ионов, находящихся в тепловом движе- нии и взаимодействующих между собой. Такими системами являются твердые тела. жидкости и газы. Состояние термодинамической системы характеризуется совокупностью небольшого числа физических величин, называемых термоди- намическими параметрами. Так для газа термодинамическими параметрами яв- ляются давление Р, объем V, и температура Т. Основные положения термоди-
намики газообразного состояния разработаны для так называемых идеальных газов.
Идеальный газ - газ, для которого выполняются следующие условия: 1. Размеры молекул газа исчезающе малы и ими можно пренебречь; 2. Силы взаимодействия между молекулами отсутствуют; 3. Столкновения молекул ме- жду собой и со стенками сосуда упругие.
Поведение одного моля идеального газа описывается уравнением Менделеева- Клапейрона;
PV = RT |
(1), |
где Р - давление, V - объем, Т - температура, R - универсальная газовая посто- янная.
Термодинамические процессы. Состояние термодинамической системы, при котором все ее параметры остаются неизменными при неизменных внеш- них условиях, называются равновесными. Переход системы из одного состоя- ния в другое называют термодинамическим процессом. Процесс, состоящий из ряда последовательных равновесных состояний, называют равновесным, Такие процессы проходят очень медленно, поскольку система должна в каждой точке прийти в состояние равновесия (например, должны выровняться температуры в
3
каждой ее точке), для чего требуется время. Всякие реальные процессы проте- кают обычно достаточно быстро и поэтому они являются неравновесными.
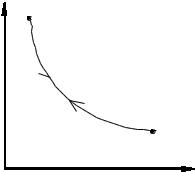
При термодинамическом процессе всегда изменяется какой-то параметр, что приводит к изменению других параметров. Так, например, если газ сжимать при постоянной температуре, т.е. уменьшать объем V, то увеличивается давле- ние Р, и такой процесс называется изотермическим. Уравнение изотермическо- го процесса записывается:
|
|
|
T = const |
|
или из (1) следует, что |
|
|
||
|
|
|
PV = const |
(2) |
|
Термодинамические процессы удобно изображать графически. Так, на- |
|||
P |
A |
пример, изотермический процесс на гра- |
||
|
|
фике зависимости P от V изображается |
||
|
|
|
||
|
|
|
гиперболой ( Рис.1 ). Различают процессы |
|
|
|
|
обратимые и необратимые. Обратимый |
|
|
|
|
||
|
|
B |
процесс есть равновесный процесс |
и он |
|
|
осуществляется абсолютно одинаково, как |
||
|
|
|
||
|
|
V |
в прямом, так и обратном направлении |
|
|
|
Рис.1. Для рассматриваемого изотермиче- |
||
|
|
Рис. 1. |
ского процесса это означает, что сжатие |
|
|
|
(процесс от В к А) и расширение (от А к |
||
В) описывается одной и той же кривой АВ. Если это условие не выполняется, то
процессы называют необратимыми и они всегда неравновесны. Причиной необратимости (неравновесности) обычно яв- ляется непроизвольный теплообмен газа с окружающей средой через стенки со- суда. Все реальные процессы, как правило, являются необратимыми. В газах кроме изотермического процесса могут проходить еще три изопроцесса: изоба- рическй - при постоянном давлении (Р = const), изохорический - при постоянном объеме (V= const) и адиабатический - процесс без теплообмена.
Внутренняя энергия газа. Одним из важных понятий термодинамики яв- ляется понятие внутренней энергии. Внутренней энергией U системы называет- ся сумма всех видов кинетической и потенциальной энергии частиц: молекул, атомов, электронов и т.д. Следовательно, она состоит из кинетической энергии поступательного, вращательного и колебательного движения молекул и атомов, а также из потенциальной энергии их взаимодействия. В идеальном газе внут-
ренняя энергия складывается только из кинетических энергий поступательного движения, т.к. молекулы не взаимодействуют и потенциальная энергия равна нулю. В молекулярной физике показывается, что кинетическая энергия атома w в газе (так называемый одноатомный газ) равна
w = 3/2 kT,
4
где k - постоянная Больцмана и Т - абсолютная температура газа (в градусах Кельвина). Атом в газе может двигаться в трех независимых друг от друга на- правлениях: вдоль оси X, Y и Z. Удобно считать, что на каждое такое направле- ние приходится определенная энергия. Поскольку все три направления движе- ния равноправны, то на каждое из них приходится энергия ( 1/2) k Т. Направле- ния движения атома называют также степенями свободы. Дадим общее опреде- ление: числом степеней свободы i какого-то тела (атома, молекулы, твердого тела и т.д.) называется число независимых механических движений, в которых может участвовать тело или число независимых координат, которые определя- ют его положение в пространстве. Отсюда ясно, что атом имеет 3 степени сво- боды, твердое тело (в том числе нелинейная молекула с жесткими связями ме- жду атомами) - 6 степеней (3 координаты X, Y, Z, определяющие центр масс тела и 3 угла вращения, определяющие ориентацию тела в пространстве. Ли- нейная молекула, например, кислорода О=О и азота N≡ N, имеет пять степеней свободы, т.к. задавать угол поворота вокруг оси молекулы не имеет смысла. Поскольку воздух состоит в основном из азота (78%) и кислорода (21%), то для него принимают i = 5. В молекулярной физике действует закон равномерного распределения энергии по степеням свободы: “На каждую степень свободы молекулы в среднем приходится кинетическая энергия, равная (1/2)kT”. Если молекула обладает i степенями свободы, то ее кинетическая энергия равна w = (i/2)kT.
Поскольку внутренняя энергия идеального газа равна сумме кинетических энергий отдельных молекул или атомов, то для одного киломоля газа она равна
U = (i/2) NA k T = (i/2) R T |
(3), |
где NA - число Авогдаро (число молекул в одном моле) и R = k NA - универ- сальная газовая постоянная.
Количество теплоты. Внутренняя энергия термодинамической системы под воздействием ряда внешних факторов может меняться, о чем, как видно из (3), можно судить по изменению температуры. Напри- мер, если быстро сжать газ, то его
d l температура повышается. При сверлении металла также наблюда- ется его нагревание. Если привести в контакт два тела, имеющих раз- ные температуры, то температура более холодного тела повышается, а более нагретого понижается. В
первых двух случаях внутренняя энергия изменяется за счет работы внешних сил, в последнем - проис-
5
ходит обмен кинетическими энергиями молекул, в результате чего суммарная кинетическая энергия молекул нагретого тела уменьшается. а менее нагретого - возрастает. Происходит передача энергии от горячего тела к холодному без со- вершения механической работы. Процесс передачи энергии от одного тела к другому без совершения работы получил название теплообмена. Передача энер- гии между телами, имеющими разные температуры, характеризуется величи- ной, называемой количеством теплоты или теплотой, т.е. количество теплоты - это энергия, переданная путем теплообмена от одной термодинамической сис- темы к другой вследствие разницы температур этих систем. Из всего сказанного следует, что теплота, энергия и работа измеряются в одних и тех же единицах: в системе СИ - в джоулях (Дж).
Работа в термодинамике. В ходе какого-то процесса газ может совер- шать работу. Пусть в цилиндре под поршнем находится какой-то газ (рис.2) Ес- ли этот газ нагревать, то в нем возрастает давление, поршень поднимается вверх, объем газа меняется от первоначального значения V1 до конечного V2 и совершается некоторая работа, которую нетрудно подсчитать. При движении поршня давление газа меняется. следовательно, и сила, действующая на пор- шень также меняется. Механическая работа А в механике находится по форму- ле:
А= ò F Cos α dl
Вданном случае α = 0 ( α - угол между силой F и элементарным переме- щением dl ) и Cos α = 1. Модуль силы F выразим через давление F = PS (давле- ние есть сила, приходящаяся на единицу площади). Тогда
dA = F Cosα dl = P S dl = P dV
где dV = S dl - элементарное приращение объема. Окончательное выражение работы запишется:
V |
|
|
A = ò1 |
P dV . |
(4) |
V2 |
|
|
Это выражение для работы, которую совершает газ при расширении, справед-
ливо для любого термодинамического процесса и является в термодинамике общим.
Первый закон термодинамики. Первый закон термодинамики является законом сохранения энергии для тепловых процессов и формулируется так:
“Количество теплоты Q, сообщаемой системе расходуется на изменение внутренней энергии (U2 - U1 ) и совершение работы A над внешними телами за счет расширения газа”. Его математическая запись:
Q = (U2 − U1 ) + A |
(5) |
6

|
|
|
|
|
|
1 |
|
|
|
|
|
Этот закон лежит в основе работы лю- |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
бых тепловых двигателей. |
|
|
2 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
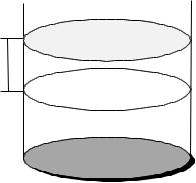
Описание работы. В данной ра- |
3 |
|
5 |
|
|
|
3 |
|
|
L1 |
боте с помощью математического мо- |
||
|
|
|
|
|
|
|
|
|
делирования, реализованного на персо- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
нальном компьютере, изучается пове- |
|
|
|
4 * |
|
|
|
|
|
|
|
дение идеального газа, находящегося в |
|
|
|
|
|
|
|
|
|
|
|
цилиндре с подвижным поршнем, при |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
изотермическом процессе и процессе |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
расширения газа при нагревании. Схе- |
|||||
|
|
|
Рис. 3 |
|
|
|
|
|
|
ма модели приведена на рис.3. Основ- |
||
|
|
|
|
|
|
|
|
|
ным элементом установки является ци- |
|||
линдр (3) с находящимся в нем газом
(5) под массивным поршнем (2). Цилиндр помещен в оболочку, которая может обеспечивать как теплоизоляцию газа от окружающей среды, так и условия для проведения изотермического процесса (стенки подогреваются или охлаждаются за счет омывания стенок жидкостью соответствующей температуры). В исход- ном положении поршень удерживается электромагнитом (1). Нагревание газа в цилиндре осуществляется нагревателем (4) (лампой). Днище цилиндра имеет клапан (6), выпускающий газ при определении силы трения скольжения поршня о цилиндр.
Описание термодинамических процессов, происходящих в цилиндре.
В работе изучается процесс изотермического сжатия и изобарического расши- рения за счет нагрева газа без теплообмена с окружающей средой. Схематиче- ски эти процессы в координатах P и V изображены на рис. 4. В начале процесса поршень поднят и удерживается электромагнитом, при этом в цилиндре - атмо- сферное давление РО и под поршнем - объем V1 (высота поршня L1) (точка А).
Затем |
осуществляется |
изотермическое сжатие газа: |
электромагнит отпускает |
||||||
P |
P2,V2,T2 |
|
|
|
|
поршень, |
который |
под действием |
|
|
|
P3,V3,T3 |
|
силы тяжести движется вниз, причем |
|||||
|
|
|
|
|
|
||||
|
B |
|
C |
|
|
температура в цилиндре поддержи- |
|||
|
|
|
|
|
|
|
вается постоянной за счет отвода те- |
||
|
|
|
|
|
|
|
пла через стенки сосуда обтекающей |
||
|
|
|
|
|
A |
|
жидкостью. Объем уменьшается до |
||
|
|
|
|
|
|
значения V2 (высота поршня L2), а |
|||
|
|
|
|
|
P0,V1 |
|
давление в газе увеличивается и рав- |
||
|
V2 |
V3 V1 |
V |
но атмосферному |
давлению плюс |
||||
|
давление |
за счет |
силы тяжести |
||||||
|
|
||||||||
поршня:
Р2 = РO + m g / S,
7
где m - масса поршня, g -ускорение свободного падения, S - площадь поршня (точка В на рис.4). Последний этап - изобарическое расширение: стенки поршня теплоизолируются, включается нагреватель в днище цилиндра, газ нагревается, расширяется и поднимает поршень. На рис.4 этот процесс изображается прямой ВС. В ходе этого процесса происходит увеличение внутренней энергии газа и совершается работа по поднятию поршня на высоту L3 (объем газа V3 ) и по преодолению сил трения между поршнем и стенками цилиндра. Процесс ВС является необратимым, поскольку вследствие трения всегда происходит рас- сеяние энергии.
Запишем первый закон термодинамики для процесса изобарического расширения. Согласно (5):
Q = (UC - UB ) + A |
(6) |
Раскроем вид каждой величины, входящей в это уравнение.
1) Q -теплота, подведенная к цилиндру нагревателем. Ее можно подсчитать как работу совершенную электрическим током:
Q = U I t, |
(7) |
где U -напряжение, I -сила тока, t -время нагревания.
2) UC - UB -изменение внутренней энергии газа за счет его нагревания при рас- ширении и согласно формуле (3) оно равно
UC - UB = (i/2)R(T3 - T2) |
(8) |
Поскольку температуры газа нам не известны, используя закон Менделеева- Клапейрона (ур.1), выразим их через P и V:
T2 = ( P2 V2 )/R и T3 = ( P3 V3 )/R |
|
Так как процесс изобарический, то |
|
Р2 = Р3 = P0 + mg/S. |
(8а) |
Тогда уравнение (8) запишется |
|
UC - UB = (i/2) P (V3 - V2) = (i/2)(P0 + mg/S)(V3 - V2 ) |
(9) |
3) A - работа, совершаемая газом, складывается из работы по |
|
поднятию поршня на высоту h = L3 - L2 : |
|
mg (L3 - L2) |
|
и из работы по преодолению сил трения поршня о стенки цилиндра: |
|
F(L3 - L2), |
|
т.е. суммарная работа равна: |
|
А = mg(L3 - L2) + F(L3 - L2) = (mg +F) (L3 - L2) |
(10) |
8

Таким образом, первый закон термодинамики (подставляя (8)-(10) в (6)) запи- шется:
QIt = (i/2)(P0 +mg/S)(V3 - V2 ) + (mg + F) (L3 - L2) |
|
или учитывая, что (V3 - V2 ) = (L3 - L2) S: |
|
Q I t = ( (i/2) S (P0 + mg/S) + mg + F ) (L3 - L2) |
(11) |
Для расчета правой части уравнения (11) необходимо знать силу трения. Она находится из модельного эксперимента с помощью второго закона Ньютона F = m a. При свободном падении поршня (клапан (6) открыт) на него действуют две силы - сила притяжения Земли Mg и противодействующая сила - сила трения (- F). Закон Ньютона запишется:
Ma = Mg - F. |
(12) |
Движение поршня равноускоренное и равно a=2s/t2 (из s = at2 /2, s -пройденный поршнем путь). Подставляя а в (12) и учитывая, что s = L1, находим силу тре- ния:
F = Mg - 2ML1 /t2 |
(13) |
О погрешностях в физических измерениях. Любое физическое измере-
ние всегда проводится с некоторой точностью - абсолютно точных измерений не существует. Источники погрешностей имеют самую разную природу: ошиб- ки, связанные с устройством измерительных приборов, с человеком. который проводит измерения, с результатами расчетов и т.д. В данной работе есть по крайней мере два таких источника: 1) значение i = 5 для воздуха справедливо приблизительно, т.к. состав воздуха сложный; 2) ошибка в определении поло- жения поршня L3 и L2 , которая моделируется компьютером.
Цель данной работы - экспериментально-модельная проверка первого на- чала термодинамики на примере вышеописанного процесса т.е. проверка спра- ведливости соотношения (11), которая заключается в определении точности , с которой оно выполняется в данном эксперименте. Эта точность оценивается по формуле:
æ |
|
((i/ 2 ) S (P |
+ mg/S) + mg + F) (L |
- L )ö |
|
|
D = ç1 |
- |
0 |
3 |
2 |
÷ |
×100% (14) |
|
U I t |
|
||||
è |
|
|
|
ø |
|
|
Выполнение работы.
1.Включить компьютер, нажав кнопку "Power" или 1 (в зависимости от машины за которой Вы сидите), Подождать, пока машина загрузится и появится общее меню (список файлов).
2.Нажать клавишу F2. На экране появится меню пользователя "User menu".
9

3.Поставить черную рамку на "Работа 77". Нажать "Enter". Появится за- ставка лабораторной работы. Далее действовать согласно инструкции, пред- ставленной на экране в каждом кадре.
Замечания: а) значения задаваемых величин вводить, исходя из пределов вели- чин, указанных на экране; б) при вводе указывать только число без указания размерности; после ввода числа обязательно нажать клавишу "Enter"; в) время t в п.6 "порядка выполнения" в одной серии измерений задавать одно и то же. г) все цифровые данные полученные в ходе работы, заносить в тетрадь.
4.После завершения выполнения работы выйти из данной программы как указано клавишей "Esc". На экране снова появится общее меню.
5.Приступить к математической обработке данных.
Математические расчеты следует проводить на компьютере с помощью про- граммы WD. Удобство программы заключается в том, что она производит расчеты в обычной форме записи формулы и не требует какой-то компьютер- ной специфики. Следует только помнить знаки арифметических действий: +,- ,*,/ - соответственно: сложение, вычитание, умножение и деление. Десятич- ная дробь записывается не через запятую, а через точку: например, 5.003, а не 5,003. Запись типа E02 на языке машины означает вторую степень (102). Осо-
бое внимание обратить на расстановку скобок в формуле для задания порядка выполняемых действий!
Войти в программу WD, для чего клавишей F2 вызвать "User menu"
Кнопкой ↓ поставить черную рамку на WD и нажать "Enter". Появится сво- бодный экран, что дает возможность проводить расчеты, записывая нужные формулы в числовых значениях. Каждый новый расчет проводить с новой строчки.
а) рассчитать силу трения о поршень; б) найти средние значения L2 и L3 ;
в) определить точность с которой выполняется первый закон термодинамики по формуле (14). Результаты представляются в виде таблицы, введенных дан- ных, данных по измерению L2 и L3 и конечного результата.
6.Закончив расчеты, выйдите из программы. Для этого нажмите клавишу F10, затем "Enter". Появится запрос, сохранить ли написанное на экране. На- жмите N. Появится общее меню, Отключите компьютер, нажав кнопку включе- ния.
10
