
- •1. Физическая химия: цель, задачи, методы исследования. Основные понятия физической химии.
- •3 .Следствия первого начала термодинамики ( изохорный и изобарный процессы). Способы записи теплот химических реакций.
- •4. Закон Гесса, его следствия. Взаимосвязь между тепловым эффектом химической реакции при постоянном объеме и давлении.
- •7. Зависимость тепловых эффектов химических реакций от температуры. Уравнение Киргоффа. Определение реакции при нестандартной температуре.
- •9. Работа расширения для идеальных газов при адиабатическом процессе. Вывести уравнения адиабат.
- •11. II закон термодинамики для обратимых и необратимых процессов. Свойства энтропии.
- •12.Расчет изменения энтропии для различных физико-химических процессов: нагревание, фазовые переходы, смешение идеальных газов, изобарный, изотермический, изохорныйпроцессы.
- •13. Расчет изменения энтропии реакции при стандартной и нестандартной температурах (на примере реакций с участием неорганических веществ)
- •14.Изохорно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса.
- •15. Изобарно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •16) Изобарно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •18) Уравнение Гиббса – Гельмгольца. Определение изменения энергии Гиббса реакции при не стандартной температуре.
- •19) Химический потенциал, определение, условие равновесия в открытых системах. Химический потенциал идеальных и реальных систем (газы, растворы).
- •20) Химическое равновесие, вывод уравнения изотермы химической реакции. Определение стандартного значения константы равновесия реакций.
- •23) Влияние температуры на константу равновесия, вывод уравнения изобары Вант- Гоффа. Принцип Ле- Шателье.
- •25) Расчёт теп.Эф х.Р. На основе изобары Вант-Гоффа (расчётный и граф. Способы).
- •26) Расчёт теп.Эф х.Р. На основе изохоры Вант-Гоффа (расчётный и граф. Способы).
- •27)Фазовые равновесия основные опр-я:
- •28)Равновесие чис-го в-ва в 2-х фазах одноком.Сис-мы.
- •29) Определение теплоты спарение расчетным и графическим способами на основе уравнения Клаузиуса – Клапейрона.
- •30) Гетерогенное равновесие. Бинарные системы. Законы Рауля. Законы Коновалова.
- •31) Основные понятия химической кинетики: скорость, механизм реакции.
- •32) Основной постулат химической кинетики. Гомогенные, гетерогенные реакции. Порядок и молекулярность реакции, отличая между ними.
- •33) Влияние концентрации на скорость химической реакции. Физический смысл, размерность константы скорости.
- •34) Кинетический анализ необратимых реакций первого порядка в закрытых системах.
- •35) Кинетический анализ необратимых реакций второго порядка в закрытых системах.
- •36) Кинетический анализ необратимых реакций нулевого порядка в закрытых системах.
- •37)Реакции 3-ого порядка
- •41. Влияние температуры на скорость химической реакции, правило Вант-Гоффа, закон Аррениуса.
- •42. Энергия активации, ее физический смысл. Методы определения энергии активации.
- •43.Катализ, основные свойства катализатора
- •44. Биогенные каталитические реакции. Кинетический анализ гомогенной каталитической реакции.
- •45. Электрохимия, особенности электрохимических реакций.
- •48. Приближения теории Дебая – Гюккеля, их концентрационные пределы применимости.
- •49) Основы теории электролитической диссоциации
- •50) Основные достоинства и недостатки тэд Аррениуса. Энергия кристаллической решетки, энергия сольватации.
- •51) Свойства буферных растворов, определение их рН, буферная емкость, диаграмма.
- •52) Определение рН гидратообразования и произведения растворимости гирооксидов металлов.
- •53. Удельная электропроводность растворов электролитов, зависимость от температуры и концентрации.
- •54. Молярная электропроводность. Закон Кольрауша. Определение молярной электропроводности при бесконечном разбавлении растворов сильных и электролитов.
- •55. Молярная электропроводность. Влияние температуры и концентрации на молярную электропроводность растворов сильных и слабых электролитов.
- •56. Электролиз, законы электролиза. Электролиз водных растворов солей с инертным анодом (привести пример).
- •57. Определение стандартного значения электродных потенциалов. Уравнение Нернста для определения эдс цепей.
- •58. Классификация электродов, правила записи электродов и цепей.
- •59.Химические цепи(гальванический элемент), их классификация.
- •60.Гальванический элемент. Термодинамика гальванического элемента.
27)Фазовые равновесия основные опр-я:
Термодин.теория фазовых равновесий и р-ров позволяет на основе опытных данных по диаграммам состояния теор.предвидеть и рассчитать условия для получения нужных продуктов путём испарения,крист-ции,экстракции и др.фаз.переходов.
Фаза-совокупность частей системы,обладающих одинаковыми термодин.св-вами и отделённых от др.частей поверх-тями раздела.
Составляющие в-ва системы(компоненты)-индивидуальные хим.в-ва,которые могут быть выделены из системы и существовать вне её.
Фазовое равновесие(гетерогенное)-равновесие в системе,состоящей из нескольких фаз.
Правило фаз Гиббса:число степеней свободы (независимых параметров)системы,на которую влияют только Т и Р,равно числу независимых компонентов минус число фаз плюс два:F=K-Ф+2.
Св-ва конден.систем прак-ки не зависят от Р,поэтому числов внеш. факторов умен-ся на ед.,а по правилу фаз опр-ся так называемая условная вариантность системы:F=K-Ф+1.
Взависимости от числа степеней свободы сис-мы дел-ся:инвариантные и конвариантные,(F=0),моновариантные(F=1)дивариантные(F=2),и т.д.При F=0 в равновесии нах-ся наибольшее число фаз для данной сис-мы.
Термодин.степенью свободы системы наз-ся число термодин.параметров,которые можно независимо менять,не меняя при этом числа и вида фаз данной системы.
В однокомпонентных системах фазы состоят из одного в-ва в различных агрегатных состояниях.Если в-во может давать различные крст-кие модиф-ции,то каждая из них яв-ся особой фазой.
Диаграмма состояния однокомпонентной системы (Н2О при средних Р до 1МПа).

3 кривые разбивают диаграмму на поля,каждое из которых отвечает одному из агрегат.состояний воды-пару,жидкости или льду.Кривые отвечают равновесию между соот-щими 2-мя фазами.
Кривая ОС хар-ет зависимость Р насыщ.пара жид.воды от Т и наз-ся кривой испарения;кривая ОВ-завис-ть Т замерзания воды от внеш.Р и наз-ся кривой плавления;кривая ОА-завис-ть плавления насыщ.пара льда от Т и наз-ся кривой возгонки.Точка О выр-ет условия одновременного равновесия между паром,льдом и жид. водой.
28)Равновесие чис-го в-ва в 2-х фазах одноком.Сис-мы.
Рассмотрим
закономерности,связанные с превращением
одной фазы чистого в-ва в другую.Сюда
можно отнести плавление,испарение,кипение,возгонку
и переход тв.тела из одной полиморфной
модиф-ции в другую.На основе соотношения
dG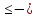 SdT
SdT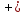 Vdp
для обратимых процессов и ур-я dGp,T=
Vdp
для обратимых процессов и ур-я dGp,T=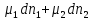 …
или dGp,T=(
…
или dGp,T=(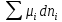 )p,T
можно
написать выр-я(1) для хим.потенциала
(одного моля) чис-го в-ва в 1-ой и 2-ой
фазах:
)p,T
можно
написать выр-я(1) для хим.потенциала
(одного моля) чис-го в-ва в 1-ой и 2-ой
фазах:
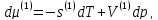
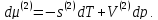
При равновесии
между фазами выполняется условие
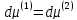 и из выр-ий
(1) получ. выр-я(2)
и из выр-ий
(1) получ. выр-я(2)
 ,
,
где
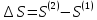 ;
;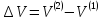 .
.
Для обратимых
изотерм.переходов
 где
где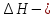 теплота
фаз.перехода;T-тем-ра
фаз.перехода.Подставляя значение
теплота
фаз.перехода;T-тем-ра
фаз.перехода.Подставляя значение
 в выр-е (2) получ. выр-е (3):
в выр-е (2) получ. выр-е (3):
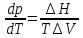 ,
наз.
урав-е Клайперона-Клаузиуса
.
,
наз.
урав-е Клайперона-Клаузиуса
.
Для процессов
испарения ур-е Клайперона Клаузиуса
(3)удобно
представить в др.виде.если рассматр.пар
при внешних условиях (Т,р),то V
данного кол-ва в-ва в парообразном
состоянии знач-но больше его V
в жид. состоянии,т.е. Vп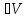 ж;поэтому
приращение объёма (4)
ж;поэтому
приращение объёма (4)
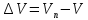 ж
ж
можно считать
прак-ки равным объёму пара и заменить
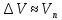 .Для
моля идеал.газа или пара (5)
.Для
моля идеал.газа или пара (5)
 .
.
С учётом соотношений (4) и (5) ур-е (3) примет вид (6):
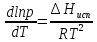 ,
где
,
где
 Hисп-молярная
теплота испарения.
Hисп-молярная
теплота испарения.
Поскольку Hисп,R,T
всегда положительны,производная
Hисп,R,T
всегда положительны,производная
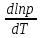 также
всегда положительна,т.е. с ростом тем-ры
давление насыщ.пара над жидкостью
всегда увел-ся.В узком интервале тем-р
можно принять приближённо величину
также
всегда положительна,т.е. с ростом тем-ры
давление насыщ.пара над жидкостью
всегда увел-ся.В узком интервале тем-р
можно принять приближённо величину
 Hисп
постоянной ;при этом интегрирование
выражения (6)даёт lnp=C-
Hисп
постоянной ;при этом интегрирование
выражения (6)даёт lnp=C-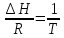 ,(7)
где С-константа интегрирования.Из ур-я
(7) видно что зависимостьlnp
от
,(7)
где С-константа интегрирования.Из ур-я
(7) видно что зависимостьlnp
от
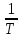 имеет линейный хар-р.по тангенсу угла
наклона прямой на графике в коор-тахlnp-
имеет линейный хар-р.по тангенсу угла
наклона прямой на графике в коор-тахlnp-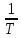 можно вычислить теплоту испарения (или
сублимации).
можно вычислить теплоту испарения (или
сублимации).
