
- •1. Физическая химия: цель, задачи, методы исследования. Основные понятия физической химии.
- •3 .Следствия первого начала термодинамики ( изохорный и изобарный процессы). Способы записи теплот химических реакций.
- •4. Закон Гесса, его следствия. Взаимосвязь между тепловым эффектом химической реакции при постоянном объеме и давлении.
- •7. Зависимость тепловых эффектов химических реакций от температуры. Уравнение Киргоффа. Определение реакции при нестандартной температуре.
- •9. Работа расширения для идеальных газов при адиабатическом процессе. Вывести уравнения адиабат.
- •11. II закон термодинамики для обратимых и необратимых процессов. Свойства энтропии.
- •12.Расчет изменения энтропии для различных физико-химических процессов: нагревание, фазовые переходы, смешение идеальных газов, изобарный, изотермический, изохорныйпроцессы.
- •13. Расчет изменения энтропии реакции при стандартной и нестандартной температурах (на примере реакций с участием неорганических веществ)
- •14.Изохорно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса.
- •15. Изобарно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •16) Изобарно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •18) Уравнение Гиббса – Гельмгольца. Определение изменения энергии Гиббса реакции при не стандартной температуре.
- •19) Химический потенциал, определение, условие равновесия в открытых системах. Химический потенциал идеальных и реальных систем (газы, растворы).
- •20) Химическое равновесие, вывод уравнения изотермы химической реакции. Определение стандартного значения константы равновесия реакций.
- •23) Влияние температуры на константу равновесия, вывод уравнения изобары Вант- Гоффа. Принцип Ле- Шателье.
- •25) Расчёт теп.Эф х.Р. На основе изобары Вант-Гоффа (расчётный и граф. Способы).
- •26) Расчёт теп.Эф х.Р. На основе изохоры Вант-Гоффа (расчётный и граф. Способы).
- •27)Фазовые равновесия основные опр-я:
- •28)Равновесие чис-го в-ва в 2-х фазах одноком.Сис-мы.
- •29) Определение теплоты спарение расчетным и графическим способами на основе уравнения Клаузиуса – Клапейрона.
- •30) Гетерогенное равновесие. Бинарные системы. Законы Рауля. Законы Коновалова.
- •31) Основные понятия химической кинетики: скорость, механизм реакции.
- •32) Основной постулат химической кинетики. Гомогенные, гетерогенные реакции. Порядок и молекулярность реакции, отличая между ними.
- •33) Влияние концентрации на скорость химической реакции. Физический смысл, размерность константы скорости.
- •34) Кинетический анализ необратимых реакций первого порядка в закрытых системах.
- •35) Кинетический анализ необратимых реакций второго порядка в закрытых системах.
- •36) Кинетический анализ необратимых реакций нулевого порядка в закрытых системах.
- •37)Реакции 3-ого порядка
- •41. Влияние температуры на скорость химической реакции, правило Вант-Гоффа, закон Аррениуса.
- •42. Энергия активации, ее физический смысл. Методы определения энергии активации.
- •43.Катализ, основные свойства катализатора
- •44. Биогенные каталитические реакции. Кинетический анализ гомогенной каталитической реакции.
- •45. Электрохимия, особенности электрохимических реакций.
- •48. Приближения теории Дебая – Гюккеля, их концентрационные пределы применимости.
- •49) Основы теории электролитической диссоциации
- •50) Основные достоинства и недостатки тэд Аррениуса. Энергия кристаллической решетки, энергия сольватации.
- •51) Свойства буферных растворов, определение их рН, буферная емкость, диаграмма.
- •52) Определение рН гидратообразования и произведения растворимости гирооксидов металлов.
- •53. Удельная электропроводность растворов электролитов, зависимость от температуры и концентрации.
- •54. Молярная электропроводность. Закон Кольрауша. Определение молярной электропроводности при бесконечном разбавлении растворов сильных и электролитов.
- •55. Молярная электропроводность. Влияние температуры и концентрации на молярную электропроводность растворов сильных и слабых электролитов.
- •56. Электролиз, законы электролиза. Электролиз водных растворов солей с инертным анодом (привести пример).
- •57. Определение стандартного значения электродных потенциалов. Уравнение Нернста для определения эдс цепей.
- •58. Классификация электродов, правила записи электродов и цепей.
- •59.Химические цепи(гальванический элемент), их классификация.
- •60.Гальванический элемент. Термодинамика гальванического элемента.
36) Кинетический анализ необратимых реакций нулевого порядка в закрытых системах.
Химическая кинетика – раздел химии, изучающий скорость и механизмы химических реакций.
При кинетических исследованиях химических реакций обычно возникают 3 типа задач:
1) изучение зависимости скорости от конц-ии реагентов определение последних во времени.
2) определение таких кинетических параметров как удельная скорость, константа скорости и энергия активации, нахождение которых является основной задачей химической кинетики.
3) исследование механизма сложных химических превращений.
Механизм реакций – совокупность элементарных стадий, слагающих процесс.
Классификация по механизму реакции:
1) Простой процесс – протекает в одну стадию (реагент → продукт);
2) Сложный процесс – многостадийный (реагент → промежуточные продукты → конечный продукт)
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Т. е. для реакции
aA + bB + dD + ……→ eE + …..
можно записать:
V = kCAx CBy CDz…..
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (соответственно х, у и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (х + у + z) представляет собой общий порядок реакции. Порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
Иногда концентрации реагента не входят в выражение для скорости, в таком случае говоря, что реакция «нулевого порядка», т.е. нулевой порядок реакции указывает на независимость скорости реакции от концентрации. Такая зависимость возможна, если:
1) концентрация постоянна; 2) реакция протекает не совсем обычным путем (например, фотохим., каталит.)
-dCA/dt = k , n = k
-dCA/dt = k
CA t
- ∫ dCA = k ∫ dt
C0A 0
C0A + CA = - kt
k0 = 1/t • (C0A - CA) = C0A - CA/t
t = C0A - CA/k0
При t = 0, C0A = a
t не равно 0, CA = a – x
k = a – (a-x)/t = x/t
dim [k0] = [моль• с-1• л-1]
Для графического определения используем:
C0A - CA = kt
- CA = kt - C0A
CA = - kt + C0A
![]()
t = t1/2 x = a/2
k0 = a/ 2t1/2
t1/2 = a/ 2k0
37)Реакции 3-ого порядка
Химическая
кинетика рассматривает скорости
химических реакций и параметры от
которых они зависят. Наиболее важными
параметрами являются концентрация,
температура, давление. Скорость реакций
в общем виде определяется изменением
количества вещества в единицу времени,
в единице реакционного пространства: ,
гдеR-
реакционное пространство, n-число
молей данного компонента в момент
времени t.Скорость
реакций выражается как производная от
концентраций по времени для любого
вещества, участвующего в реакций.
,
гдеR-
реакционное пространство, n-число
молей данного компонента в момент
времени t.Скорость
реакций выражается как производная от
концентраций по времени для любого
вещества, участвующего в реакций.
Важной
характеристикой в химической кинетике
является константа скорости. Ее
физический смысл состоит в том, что
при условии равенства концентрации
реагирующих веществ(Са=Св=1) для гомогенных
реакции константа скорости равна
скорости реакции W=k,
а для гетерогенных реакции
 .
.
Из всех кинетических характеристик химических реакции наиболее важной является константа скорости. Чем больше по величине константа скорости , тем больше скорость. Рассмотрим р-ции 3-его порядка с точки зрения кинетики. Есть 2 типа р-ции 3-его порядка
1)3А=С –при вз-ии получается один продукт
2)А+В+С=Е+Д+Ж-при вз-ии получается несколько продуктов.
1)СА+СВ+СС}=СА



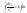

 ;
;
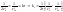 и
и

 ;
;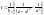 Для графического определения используем
ур-ие:
Для графического определения используем
ур-ие: .
.
 x=a/2
x=a/2
 .
Еще
одной кинетической характеристикой
реакции является период
полупревращения
t1/2
– время, за которое концентрация
исходного вещества уменьшается вдвое
по сравнению с исходной. Выразим t1/2
для реакции третьего порядка, учитывая,
что
.
Еще
одной кинетической характеристикой
реакции является период
полупревращения
t1/2
– время, за которое концентрация
исходного вещества уменьшается вдвое
по сравнению с исходной. Выразим t1/2
для реакции третьего порядка, учитывая,
что
 x=a/2
x=a/2
 .Для
реакции 3-его порядка период полураспада
обратно пропорционален квадрату исх.с.
Единица измерения К,т.е. dim
.Для
реакции 3-его порядка период полураспада
обратно пропорционален квадрату исх.с.
Единица измерения К,т.е. dim .
Таким образом, химическая кинетика-раздел
химии,изучающий скорость и механизмы
химических реакции, как было рассмотрено
выше.
.
Таким образом, химическая кинетика-раздел
химии,изучающий скорость и механизмы
химических реакции, как было рассмотрено
выше.
38-40)определить константу скорости первого и n-ого порядка расчетным и графическим способом, укажите ее размерность.уравнение расчета периода полураспада реакций 1-ого порядка.
Химическая
кинетика рассматривает скорости
химических реакций и параметры от
которых они зависят. Наиболее важными
параметрами являются концентрация,
температура, давление. Скорость реакций
в общем виде определяется изменением
количества вещества в единицу времени,
в единице реакционного пространства: ,
гдеR-
реакционное пространство, n-число
молей данного компонента в момент
времени t.Скорость
реакций выражается как производная от
концентраций по времени для любого
вещества, участвующего в реакций.
,
гдеR-
реакционное пространство, n-число
молей данного компонента в момент
времени t.Скорость
реакций выражается как производная от
концентраций по времени для любого
вещества, участвующего в реакций.
Важной
характеристикой в химической кинетике
является константа скорости. Ее
физический смысл состоит в том, что
при условии равенства концентрации
реагирующих веществ(Са=Св=1) для гомогенных
реакции константа скорости равна
скорости реакции W=k,
а для гетерогенных реакции
 .
.
Из всех кинетических характеристик химических реакции наиболее важной является константа скорости. Чем больше по величине константа скорости , тем больше скорость.
Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка А ––> В. Реакции первого порядка характеризуются кинетическим уравнением вида

 .
.
 (1а)
(1а)
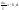




 (1б)
(1б)
 (1в)
(1в)
 (1г)
(1г)
Константу
интегрирования определим из начальных
условий: в момент времени t = 0 концентрация
С0=a,или
 прореагировало х молей вещества.Тогда
прореагировало х молей вещества.Тогда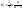 (1д).
(1д). (1ж)
(1ж)
Для
графического определения используется
уравнение (1б) в результате получаем: (1е)
(1е)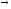
 -
уравнение прямой.В результате можно
построить график зависимости логарифма
концентрации от времени реакции первого
порядка
-
уравнение прямой.В результате можно
построить график зависимости логарифма
концентрации от времени реакции первого
порядка
![]()
Можно
проследить, что логарифм концентрации
для реакции первого порядка линейно
зависит от времени (рис. 2.3) и константа
скорости численно равна тангенсу угла
наклона прямой к оси времени: .
.
Из
уравнения 1б и 1д видно, что К зависит
от концентрации исходных веществ.
Уравнения 1в 1д 1е- кинетические уравнения
первого порядка.Единица измерения
К,т.е. dim[K]=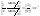
Еще
одной кинетической характеристикой
реакции является период
полупревращения
t1/2
– время, за которое концентрация
исходного вещества уменьшается вдвое
по сравнению с исходной. Выразим t1/2
для реакции первого порядка, учитывая,
что С = ½Со:

 (1з).
(1з).
Как видно из полученного выражения, период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества.Таким образом,химическая кинетика-раздел химии,изучающий скорость и механизмы химических реакции,как было рассмотрено выше.
