
Физ химия и физ т.д
..pdf
Х и м и ч е с к а я к и н е т и к а
([FeOH ]2+ представляет собой ион OH − в координационной сфере иона Fe3+ )
образуется свободный радикал OH , который легко (через линейный трехчленный активированный комплекс) отрывает атом H у бензола
C6 H6 + OH →C6 H5 + H2O
с образованием свободного фенила. Последний еще с одним радикалом OH дает фенол
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
C6 H5 + OH →C6 H5OH. |
|
|
|
||||||
В результате протекает суммарный процесс |
|
|
|
|
||||||||
2Fe2+ + 2H |
O + C H |
6 |
→ 2[FeOH ]2+ + H |
O + C H |
OH , |
|||||||
2 |
|
2 |
6 |
|
|
|
2 |
|
6 |
5 |
|
|
представляющий собой сумму реакции (2.202) и реакции окисления |
||||||||||||
|
|
|
2Fe2+ + H |
O → 2[FeOH ]2+ |
. |
|
(2.203) |
|||||
|
|
|
|
|
|
2 |
|
2 |
|
|
|
|
Реакции (2.202) |
и (2.203) |
являются конкретным примером сопряженных |
||||||||||
реакций, выраженных в общем случае уравнениями ( |
2.200) и (2.201). |
|||||||||||
Вещество A1 ( H2O2 |
в рассмотренном примере), участвующее в обеих ре- |
|||||||||||
акциях, называется актором. |
|
|
|
|
|
|
|
|||||
Вещество X ( Fe2+ в рассмотренном примере), легко реагирующее с актором и индуцирующее реакцию (2.200) [(2.202) в рассмотренном примере],
называется индуктором.
Вещество A2 (C6 H6 в рассмотренном примере), взаимодействие которого
в системе с актором возможно только при наличии химической индукции, называется акцептором.
Причиной химической индукции является возникновение в процессе реакции активных частиц, которые способны реагировать как с индуктором, так и с акцептором. Такими активными промежуточными продуктами в одних системах являются радикалы, в других – активные ионы, в третьих – лобильные комплексы и молекулы. В рассмотренном нами примере активными частицами,
вызывающими химическую индукцию, являются радикалы OH . Количественной характеристикой химической индукции служит фактор
индукции Φ , равный отношению скорости расходования акцептора vакц к скорости расходования индуктора vинд:
Φ = |
vакц |
. |
(2.204) |
|
|||
|
vинд |
|
|
81
Х и м и ч е с к а я к и н е т и к а
Именно расходованием индуктора явление сопряжения (индукции) отличается от катализа. При катализе промежуточные соединения или комплексы разрушаются с регенерацией катализатора и фактор индукции при идеальном катализе равен бесконечности1. В то же время, для сопряженных реакций очень часто с увеличение отношения сакц / синд ( сакц и синд – соответственно концен-
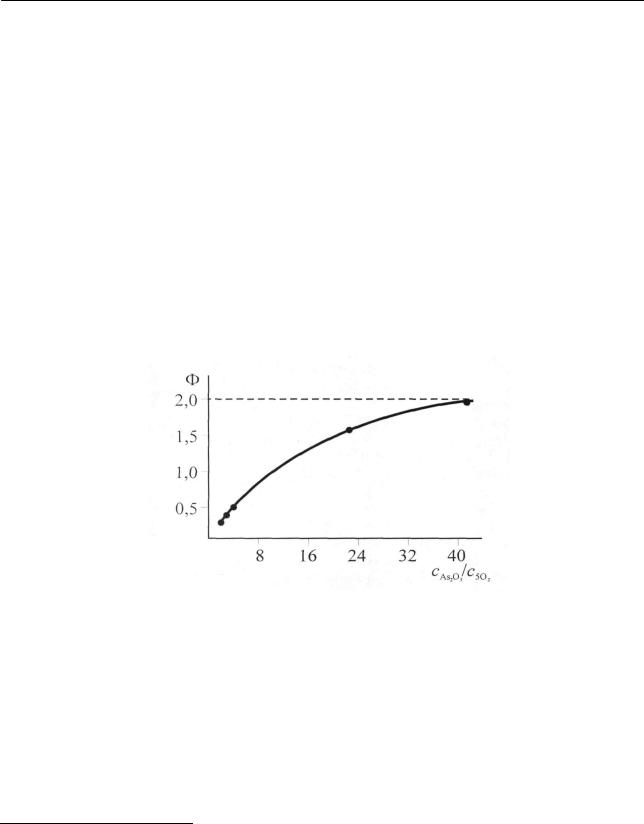
трации акцептора и индуктора) фактор индукции стремится к некоторому пределу, который характеризует отношение стехиометрических коэффициентов реакции генерирования промежуточного продукта и его взаимодействия с акцептором. На рис. 2.22 для примера приведена зависимость фактора индукции от отношения концентраций акцептора к индуктору для исследованного Шиловым окисления бромноватой кислотой (актор), сернистой (индуктор) и мышьяковистой (акцептор) кислот2:
Первичный процесс HBrO3 + SO2 Вторичный процесс HBrO3 + As2O3 .
Рис. 2.22. Зависимость фактора индукции от отношения концентраций акцептора и индуктора
Как видно, фактор индукции стремится к постоянному значению, равному двум.
Следует отметить, что известны также явления, свидетельствующие о переходе индукции в катализ. Примером является изученная Шиловым реакция окисления тиосульфата натрия персульфатом калия до тетратионата в присут-
ствии ионов Fe3+ и Fe2+. В присутствии ионов Fe3+ реакция является катали-
1 Отмеченное следует из уравнения (2.204), в котором для случая катализа имеем vинд =vкат = 0 , где vкат – скорость расходования катализатора.
2 Из неорганической химии (см., например [17]) известно, что сернистую и мышьяковистую кислоту следует скорее считать гидратированными оксидами. Поэтому при написании химических реакций с участием этих кислот мы соответственно записываем SO2 и As2O3 .
82

Х и м и ч е с к а я к и н е т и к а
тической – ее скорость прямо пропорциональна концентрации ионов Fe3+ . Ио-
ны Fe2+ значительно активнее ионов Fe3+ , однако здесь отсутствует пропорциональность между скоростью реакции и концентрацией солей железа. Шилову путем торможения катализа добавками кислоты или фторида натрия удалось
показать, что на один ион Fe2+ окисляется одна молекула тиосульфата. Следовательно, имеет место сопряженное окисление тиосульфата и иона Fe2+, кото-
рый, переходя в Fe3+ , становится катализатором.
К сопряженным реакциям относятся также самосопряженные реакции (явление самоиндукции), при которых концентрация индуктора возрастает в ходе процесса. Обязательным свойством самоиндуктивных процессов, но не свойством только самоиндуктивных процессов 1, является начальное ускорение реакции и прохождение ее скорости через максимальное значение.
Согласно Шилову схему самоиндуктивного процесса можно представить в следующем виде.
1. Исходные вещества первоначально образуют некоторые продукты A′ и
B′
2.Продукт A′ взаимодействует с одним из исходных веществ, давая новое промежуточное соединение A′′.
3.Новый промежуточный продукт при взаимодействии с другим исходным веществом регенерирует первый, т.е. A′.
В целом эту схему можно записать так:
1.A + B → A′ + B′
2.A′ + A → A′′
3.A′′ + B → A′ + B′.
При этом первый процесс считается протекающим наиболее медленно.
Одной из экспериментально изученных Шиловым самоиндуктивных реакций является окисление мышьяковистой кислоты бромноватой. Реакция ускоряется бромистоводородной кислотой. В отсутствии HBr и в слабокислых рас-
творах реакция вообще не идет. При бьльшей концентрации ионов H + реакция начинается самопроизвольно, но имеет отчетливый индукционный период. В этом начальном периоде зарождения реакции идет образование некоторого количества HBr:
0. 2HBrO3 + 3As2O3 → 2HBr + As2O5 очень медленная реакция.
Дальнейшее окисление происходит при участии индуктора HBr:
1 См., например последовательные и автокаталитические реакции.
83

Х и м и ч е с к а я к и н е т и к а
1. HBrO3 + HBr = HBrO2 + HBrO |
медленная реакция |
2.4HBr + HBrO + HBrO = 3Br + 3H O |
|
быстрые реакции
3.2Br2 + As2O3 + 2H2O = As2O3 + 4HBr
Вреакциях 0 и 3 индуктор образуется, а в 1 и 2 – расходуется. Поскольку происходит накопление индуктора HBr и энергичного окислителя Br2 , то весь про-222
цесс является самоиндукционным. Таким образом, причиной ускорения явля-
ется образование высокореакционного промежуточного продукта (Br2 ),
исчезающего в конце реакции. В этом видят существенное отличие самоиндуктиных процессов от каталитических и автокаталитических. В каталитических ускоритель присутствует в системе с самого начала и не исчезает при завершении реакции. В автокаталитических – катализатор образуется в ходе реакции в качестве конечного продукта, накапливается и также исчезает к концу реакции.
С другой стороны, в этом можно видеть и сходство с обсужденными ранее цепными реакциями, в частности, с разветвленными цепными – в этих последних также происходит накопление активных промежуточных продуктов, веддущих к самоускорению реакции. Однако дискуссионные вопросы о том является ли схема Шилова цепной или нет, как и о случайности или закономерности совпадения кинетических уравнений данных Шиловым для самоиндуктивных процессов с уравнением автокаталитических реакций, в частности с уравнением Оствальда (2.189), выходят за рамки настоящего рассмотрения.
Важная особенность химической индукции (сопряженных химических реакций) – возможность проведения реакции (2.200) с увеличением энергии Гиб-
бса, т.е. ∆G1 > 0 , если одновременно протекающая реакция (2.201) сопровождается изменением: ∆G2 < −∆G1. Суммарное изменение энергии Гиббса при этом
∆G = ∆G1 + ∆G2 < 0,
т.е. отрицательно, и такой процесс может протекать самопроизвольно [2].
Это свойство сопряженных реакций играет исключительно важную роль в живой природе. Так. например, синтез важнейших компонентов живой материи – белков и нуклеиновых кислот соответственно из аминокислот и нуклеотидов сопровождается существенным увеличением энергии Гиббса. Возможными эти процессы становятся потому, что протекают сопряжено с гидролизом аденозинтрифосфорной кислоты (АТФ), сопровождающимся существенным уменьшением энергии Гиббса, перекрывающим ее рост при синтезе указанных полимеров. Наоборот, образование АТФ из продуктов ее гидролиза, сопровождающееся увеличением энергии Гиббса, происходит сопряжено с окислением органических соединений, идущим с существенным уменьшением энергии Гиббса.
84

Х и м и ч е с к а я к и н е т и к а
D. Реакции с нетермической активацией реагирующих веществ
Для осуществления химической реакции необходима определенная энергия, равная или превышающая энергию активации (см. 2.2.1.6). При этом активные частицы находятся в термическом равновесии с остальными молекулами. Подобные реакции часто называют термическими.
Кроме них существует класс реакций с нетермической активацией реа-
гирующих веществ. В этих реакциях необходимая для активации молекул энергия поступает к взаимодействующим молекулам извне, например, при поглощении кванта электромагнитного излучения, при столкновении с электроном или протоном, при взаимодействии плазмы и электрического разряда. Таким образом, с термодинамической точки зрения [1,2] эти реакции являются несамопроизвольными, т.е. протекающими при положительном изменении энергии Гиббса или энергии Гельмгольца ( ∆G > 0 или ∆A > 0 ). Например, для
реакция фотосинтеза
6CO2 + 6H2O hν →C6 H12O6 + 02
∆G0 = 2860кДж/ моль. Фотосинтез протекает под действием солнечной энергии в листьях растений. Благодаря ему осуществляется кругооборот кислорода и углерода в природе.
Реакции с нетермической активацией разделяют по способу активации. Если реакция происходит при поглощении квантов электромагнитного из-
лучения, в том числе и квантов света1, то ее называют фотохимической, а раздел химии, изучающий подобные реакции, – фотохимией.
Реакции, которые происходят в плазме электрического разряда, называют
плазмохимическими, а раздел химии – плазмохимией, или газовой электрохимией.
Реакции, протекающие при воздействии быстрых элементарных частиц или гамма–излучения, относят к радиационно-химическим, а соответствующий раздел химии называют радиационной химией.
Помимо специфических особенностей, реакции с нетермической активацией имеют некоторые общие признаки. Так, у них есть две общие стадии. Первая стадия связана с возникновением активных, более реакционноспособных частиц и увеличением их доли под воздействием внешних факторов. Вторая стадия заключается во взаимодействии активных частиц с другими частицами или друг с другом.
При нетермической активации возникает гораздо больше активных частиц, чем при их термическом образовании. Концентрация получающихся продуктов реакции, в результате сказанного, значительно выше равновесных концентраций для термических реакций. Таким образом, в реакциях с нетермической ак-
1 Квант – определенное количество – «порция». Величина кванта энергии излучения равна hν , где ν – частота излучения, h – постоянная Планка.
85

Х и м и ч е с к а я к и н е т и к а
тивацией обеспечивается сверхравновесный выход продуктов. Поэтому для этих реакций термодинамический подход не всегда оправдан. Так как скорость первой стадии нетермических реакций не зависит от температуры, то температура незначительно изменяет скорость реакции в целом.
Более подробно остановимся на фотохимических реакциях (фотолизе),
происходящих под действием света. Свет вызывает развитие многих реакций, как цепных, так и нецепных. Реагирующие частицы под действием света получают избыточную энергию и становятся более реакционноспособными.
Общие закономерности фотохимических реакций описываются следующими законами фотохимии.
Закон Гротгуса – Дрепера, часто называемый первым законом фотохи-
мии: только поглощаемое средой световое излучение может произвести ее химическое изменение. Это необходимое, но не достаточное условие для того, чтобы осуществлялась фотохимическая реакция. Многие химические системы поглощают световую энергию без каких-либо химических изменений.
Закон фотохимической эквивалентности Эйнштейна, часто называе-
мый вторым законом фотохимии: каждый поглощенный квант света в
первичном акте способен активизировать только одну молекулу.
Количественная зависимость между скоростью фотохимической реакции и количеством поглощенной энергии, установленная Вант-Гоффом:
количество химически изменяемого вещества пропорционально количеству поглощенной световой энергии.
Закон Бугера – Ламберта – Бера: доля поглощенного излучения про-
порциональна числу молекул на пути светового потока
Исходя из закона Бугера – Ламберта – Бера интенсивность I светового потока после прохождения через слой вещества толщиной l равна
I = I0e−εcl , |
(2.205) |
где I0 – начальная интенсивность светового потока; ε |
–молярный коэффици- |
ент поглощения; с – концентрация вещества, поглощающего свет. Отсюда количество поглощенной световой энергии E будет равно
E = I0 − I = I0 − I0e−εcl = I0 (1 − e−εcl ). |
(2.206) |
Скорость фотохимической реакции, исходя из закона Вант-Гоффа, пропорциональна E:
dc |
′ |
(1 − e |
−εcl |
), |
(2.207) |
− dτ |
= k I0 |
|
где k′ – коэффициент пропорциональности. При εcl 1
− |
dc |
′ |
, |
(2.208) |
dτ |
= k I0 |
|||
|
|
|
|
86

Х и м и ч е с к а я к и н е т и к а
реакция протекает по нулевому порядку. При εcl 1, e−εcl ≈1 −εcl , тогда
− dc |
= kc , |
(2.209) |
dτ |
|
|
и реакция протекает по уравнению первого порядка с константой скорости k = k′εlI0 .
Важными характеристиками фотохимической реакции являются квантовый выход первичной фотохимической реакции и полный квантовый выход фото-
химического процесса. Квантовый выход первичной фотохимической реакции
γI – отношение числа прореагировавших возбужденных молекул в пер-
вичной фотохимической реакции к числу поглощенных квантов. Полный квантовый выход фотохимического процесса γ – отношение числа действи-
тельно прореагировавших или образовавшихся в результате процесса молекул к числу поглощенных квантов. Квантовый выход первичной фотохи-
мической реакции не может быть больше единицы, в то время, как полный квантовый выход фотохимического процесса может быть меньше и много больше единицы. Для реакций, протекающих в растворах, обычно γ <1. Низкие
значения квантовых выходов реакций в растворах обусловливаются высокими скоростями дезактивации возбужденных молекул и рекомбинацией частиц, образовавшихся в результате распада молекул. Высокие квантовые выходы (γ 1) обычно свидетельствуют о протекании цепной реакции: один погло-
щенный квант вызывает превращение большого числа молекул.
Исходя из введенного понятия полного квантового выхода фотохимического процесса, скорость фотохимической реакции можно записать в следующем виде:
v =γv0 , |
(2.210) |
где v0 – число молей вещества, которое в единицу времени в единице объема
активируется под действием световой энергии и может участвовать в первичной фотохимической реакции.
На основании второго закона фотохимии количество энергии Eм, поглощаемой одним молем вещества, определяется по уравнению
Ем = NAhv , |
(2.211) |
где NA = 6,022 1023 моль−1 – число Авогадро; h = 6,626 10−34 Дж с – постоянная Планка; ν –частота излучения. В соответствии с (2.211) величину v0 в выражении (2.210) для скорости фотохимической реакции можно рассчитать по уравнению
87

Х и м и ч е с к а я к и н е т и к а
v |
= |
E |
= |
E |
, |
(2.212) |
|
|
|||||
0 |
|
Eм |
|
NAhν |
|
|
|
|
|
|
|
где E – световая энергия, которая поглощается единицей объема системы в единицу времени. Подставляя полученное значение v0 в (2.210), получаем
окончательное выражение для скорости фотохимической реакции
v = |
γ |
E . |
(2.213) |
|
NAhν |
||||
|
|
|
Выражение (2.207), полученное нами ранее для скорости фотохимической реакции, с учетом (2.206) можно переписать в виде
|
′ |
(2.214) |
|
v = k E . |
|||
Сопоставление выражений (2.213) и |
(2.214) |
позволяет определить значение |
|
коэффициента пропорциональности k′ в уравнении (2.207) |
|||
k′ = |
γ |
(2.215) |
|
|
. |
||
NAhν |
|||
Процесс взаимодействия молекулы A с квантом энергии hν и последующим химическим превращением A в продукты реакции
A + hν → A → Продукты
является элементарным актом первичной фотохимической реакции. В эле-
ментарном акте можно выделить две стадии. На первой стадии молекула в результате взаимодействия с квантом энергии переходит в возбужденное состояние. Эта стадия протекает с большими скоростями и завершается приблизи-
тельно за 10−15 с. После поглощения (абсорбции) кванта энергии электромаг-
нитных колебаний возбужденная молекула A может распасться на радикалы, превратиться в изомерную молекулу A′ или прореагировать с другими молекулами, находящимися в системе. Но возможны и другие, физические процессы, в результате которых возбужденная молекула в той или иной форме теряет избыток энергии и переходит в невозбужденное состояние. Если обозначить скорость активации молекул через v1 , скорость дезактивации – через v2 и скорость
химической реакции – через v , то скорость изменения концентрации активных молекул в системе −dc / dτ будет равна
− |
dc |
=v |
−v |
2 |
−v . |
(2.216) |
|
dτ |
1 |
|
|
|
|
|
|
|
|
|
|
Учитывая, что концентрация активных молекул относительно мала, воспользовавшись методом стационарных концентраций, можем написать
88

Х и м и ч е с к а я к и н е т и к а
v1 −v2 −v ≈ 0 ,
откуда
v =v1 −v2 .
Таким образом, на скорость фотохимической реакции в существенной степени будут влиять процессы абсорбции света и дезактивации возбужденных молекул.
Воспользуемся основными положениями формальной кинетики для описания общей скорости фотохимической реакции. Пусть скорость образования возбужденных молекул равна
v1 = k1cA = k1′εlIocA ,
где k1 – константа скорости, а k1′ – коэффициент пропорциональности, отвечающий выражению, идентичному (2.215); скорость дезактивации A за счет излучательных переходов, т.е. за счет обратного испускания кванта света
v2 = k2cA ;
скорость дезактивации A за счет безизлучательных переходов с превращением энергии в тепловые формы движения
|
|
|
|
|
v3 |
= k3c |
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
и скорость химической реакции |
|
|
|
|
|
|
|||||
|
|
|
|
|
v4 |
= k4c |
|
|
. |
|
|
|
|
|
|
|
|
|
A |
|
|
||
В таком случае уравнение (2.216) можно записать в форме |
|
||||||||||
|
dc |
|
|
|
′ |
|
|
|
|
|
(2.217) |
− |
|
A |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||||
dτ |
|
|
= k1εlI0cA − (k2 + k3 + k4 )c . |
|
|||||||
|
|
|
|
|
|
|
A |
|
|
||
Применяя метод стационарных концентраций, полагая |
dc / dτ ≈ 0 , получа- |
||||||||||
ем |
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c |
|
|
′ |
|
|
|
+ k3 + k4 ) |
|
(2.218) |
|
|
|
= k1εlI0cA / (k2 |
|
||||||||
|
|
|
A |
|
|
|
|
|
|
||
и |
|
|
|
|
|
|
|
|
|
|
|
|
v4 |
|
′ |
|
|
|
+ k3 + k4 ). |
|
(2.219) |
||
|
= k4 k1εlI0cA / (k2 |
|
|||||||||
Квантовый выход первичной фотохимической реакции равен |
|
||||||||||
|
|
|
|
|
γI = k4 / (k2 + k3 + k4 ). |
|
(2.220) |
||||
В том случае, если A взаимодействует с B, то уравнения (2.219) |
и (2.220) |
||||||||||
примут следующий вид: |
|
|
|
|
|
|
|
|
|
|
|
89

Х и м и ч е с к а я к и н е т и к а
′ |
/ (k2 |
+ k3 + k4cB ), |
(2.221) |
v4 = k4k1εlI0cAcB |
|||
γI = k4cB / (k2 + k3 + k4cB ). |
(2.222) |
||
Из (2.220) и (2.222) видно, что γI не может быть больше единицы. При k4cB k2 + k3 v4 = k1′εlI0cA , где коэффициент пропорциональности k1′, как видно из выражения (2.215), не зависит от температуры. В этих случаях энергия
активации (см.2.2.1.6) первичной фотохимической реакции равна нулю. Это справедливо только для элементарной фотохимической реакции, т.е. для превращения электронно-возбужденой частицы. Если в результате фотохимической реакции возникают высоко реакционноспособные частицы (свободные атомы и свободные радикалы), то начинается сложное химическое превращение, включающее и нефотохимические – темновые стадии (процессы). За счет темновых стадий, скорость которых может зависеть от температуры, последняя будет влиять и на процесс в целом. Следовательно, если первичная фотохимическая реакция завершается каким-либо вторичным темновым процессом, то энергия активации процесса в целом будет больше нуля.
В некоторых случаях реакции могут протекать при поглощении света посторонними веществами, которые сами не участвуют в реакции. Такие реакции называются сенсибилизированными, а добавляемые вещества, вызывающие (или ускоряющие) фотохимические реакции, – сенсибилизаторами.
Примером широкого применения сенсибилизации в фотографии является изменение чувствительности фотоэмульсии при введении в нее определенных красителей. Последние могут не только повышать чувствительности эмульсии, но и изменять спектральную область чувствительности.
Наиболее сложный и тонкий механизм, называемый фотосенсибилизацией, проявляется при фотосинтезе растениями сложных органических соединений из простых молекул CO2 и H2O . Роль сенсибилизатора выполняет хлоро-
филл в виде сложных надмолекулярных биоструктур – хлоропластов.
И, наконец, отметим, что к фотохимическим процессам относится также
люминесценция, которая подразделяется на флуоресценцию (фотолюминесценцию), фосфоресценцию и хемилюминесценцию.
2.2.1.6. Зависимость скорости реакции от температуры. Определение энергии активации
Скорость подавляющего большинства химических реакций, за крайне редкими исключениями, быстро увеличивается с повышением температуры, что нашло широчайшее применение в химической практике. Через какие же величины температура влияет на скорость реакции? Скорость реакции согласно основному закону кинетики определяется уравнением типа (2.23), указывающим
на принципиальную возможность осуществления влияния на нее температуры
90
