
Физ химия и физ т.д
..pdf
Х и м и ч е с к а я к и н е т и к а
Изучение способности того или иного газа поддерживать скорость мономолекулярной реакции используется как метод определения скорости передачи энергии от одних молекул другим [9].
Рассмотренный выше материал наглядно показывает возможности принципа стационарности при анализе кинетики сложных реакций. Завершая рассмотрение весьма важного, хотя и приближенного, метода кинетического рассмотрения сложных реакций – метода стационарных концентраций, часто связываемого с именем Боденштейна, сформулируем (без вывода) условия достижения квазистационарного режима в реакциях состоящих из нескольких последовательных стадий (односторонних и двусторонних) первого порядка.
1.Последовательность односторонних (необратимых) стадий будет квазистационарной. Если константа скорости первой стадии значительно меньше констант скорости всех остальных стадий.
2.Последовательность двусторонних (обратимых) стадий будет квазистационарной, если она включает одну стадию, обе константы скорости которой много меньше констант скорости всех остальных стадий в прямом и обратном направлении.
3.Последовательность, включающая двусторонние и односторонние стадии, будет квазистационарной, если константа скорости первой из односторонних стадий будет значительно меньше констант скоростей остальных односторонних стадий.
C. Основные типы механизмов химических реакций с участием промежу-
точных частиц В предыдущем изложении мы уже сталкивались с тем, что многие процес-
сы, описываемые простым стехиометрическим уравнением, являются сложными и протекают с помощью активных промежуточных частиц. Основная причина этого обусловлена тем фактом, что обычно прямое превращение связано с преодолением высокого энергетического барьера. Появление же новых химически активных частиц приводит, в свою очередь, к новым путям протекания реакций, причем эти пути характеризуются низким энергетическим барьером.
Характерным примером сказанному может служить протекающая по цепному механизму реакция взаимодействия молекул водорода и иода. Протекание прямого превращения в соответствии с уравнением (2.12), связанного с одно-
временным разрывом двух связей и образованием двух новых, энергетически менее вероятно по сравнению со стадией (a) реакции (2.13), протекающей в ре-
зультате появления активного атома иода, по новому пути, связанному с одновременным разрывом и образованием всего лишь одной связи.
Для некоторой реакции между двумя молекулами
A1 + A2 → B1 + B2 |
(2.173) |
естественно существует некоторая малая вероятность протекания как элементарной со скоростью v0 = k0cA1 cA2 . Наличие второго, сложного пути с превра-
61

Х и м и ч е с к а я к и н е т и к а
щением одной из частиц, например A1 в некоторую химически более активную частицу A1 , которая, реагируя с A2 дает тот же конечный продукт, например B1 , но существенно быстрее –
|
A1 + A2 → B1 . |
|
(2.174) |
B2 можетобразоваться как в этой же ситуации, так и в предыдущей. Понятно, |
|||
что не все молекулы |
A сразу же переходят в A . Наоборот, так как A – актив- |
||
|
1 |
1 |
1 |
ная промежуточная частица, то ее концентрация чаще всего квазистационарна и поэтому мала. Скорость реакции (2.174)
v1 = k1cA1 cA2 .
Следовательно, отношение скоростей одностадийной реакции (2.173) и реак-
ции (2.174)
v1 /v0 = k1cA1 / k0cA1 .
Исходя из этого можно заключить, что реакция A1 с A2 будет протекать как
сложная реакция с участием активных промежуточных частиц, если выполняется неравенство
k1 / k0 |
cA |
/ c , |
(2.175) |
|
1 |
A1 |
|
т.е. если выигрыш в величине константы скорости при переходе к реакции (2.174) превосходит проигрыш в концентрации, связанный с тем, что один из
участников реакции присутствует в низкой концентрации.
Для реакций, развивающихся в условиях взаимодействия элементарных актов, наблюдаемая скорость не является результатом простого суммирования. Другими словами, для таких реакций нарушается принцип независимости, являющийся одним из постулатов химической кинетики. Сюда относятся так на-
зываемые сопряженные и, в первую очередь, цепные реакции.
Цепные реакции1– это химические реакции, в которых появление ак-
тивной частицы вызывает большое число превращений неактивных молекул вследствие регенерации активной частицы в каждом элементарном акте реакции. При этом, в ходе реакции активирование одной частицы приводит к тому, что не только данная частица, но последовательно целый ряд других частиц вступает в реакцию, в результате чего кроме продуктов реакции возникают новые активные частицы.
Типичные цепные реакции – галогенирование, окисление, полимеризация, ядерные процессы.
1Данный вопрос в учебной литературе детально рассмотрен в [12]. 62
Х и м и ч е с к а я к и н е т и к а
Цепными являются также многие процессы, связанные с пищевой промышленностью, а именно прогоркание жиров, окисление красящих веществ в процессе созревания красных вин и ряд других.
Активными частицами являются атомы, обладающие неспаренными электронами, свободные радикалы, несольватированные ионы, возбужденные молекулы, т.е. частицы с нескомпенсированной валентностью.
Большинству цепных реакций свойственны некоторые общие особенности, отличающие их от других реакций.
Скорость рассматриваемых реакций характеризуются большой чувствительностью к примесям, которые могут как инициировать и ускорять реакции, так и тормозить их.
На скорость многих газовых реакций оказывает влияние присутствие твердых поверхностей. Чаще всего наблюдается замедление реакции твердыми поверхностями – стенками реакционных сосудов – и в узких сосудах реакции идут медленнее, чем в широких. В этих случаях принято говорить о влиянии на скорость реакции отношения поверхности сосуда S к его объему V. В соответствии со сказанным газовые реакции обсуждаемого типа замедляются при увеличении S/V. На практике это отношение можно изменить, вводя в сосуд осколки материала сосуда – стекла, фарфора, кварца. Если в заполненном осколками сосуде (величина S/V больше) реакция идет медленнее, то это является признаком, хотя и не однозначным, ее принадлежности к цепным процессам.
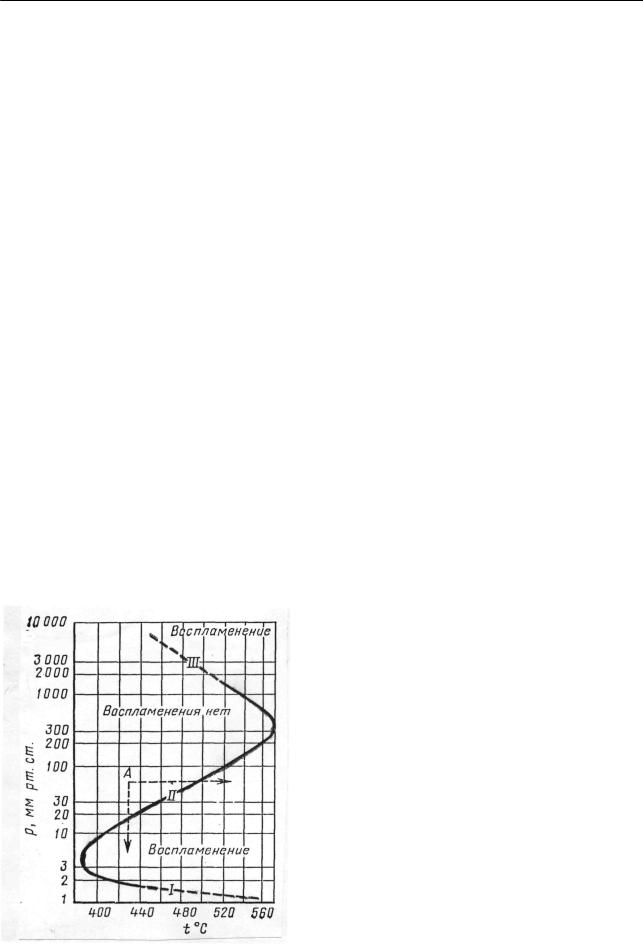
При реакциях окисления в газовой фазе часто быстрая реакция – самопроизвольное воспламенение – осуществляется лишь в определенных пределах давления и температуры. Графическое изображение наблюдаемых при этом соотношений называют полуостровом воспламенения. Для примера на рис. 2.16 приведены характерные данные для рассматриваемых реакций, относящиеся к окислению водорода.
Рис. 2.16. Полуостров воспламенения при реакции окисления водорода.
Три предела воспламенения: I – нижний, II – верхний, III – третий
63

Х и м и ч е с к а я к и н е т и к а
Воспламенение гремучей смеси происходит только при условиях соответствующих точкам внутри полуострова воспламенения. Вне его пределов воспламенения не происходит – реакция идет медленно или даже не идет вовсе. Исходя из точки A (рис. 2.16), воспламенение смеси можно вызвать, нагревая ее (стрелка вправо) до состояния, соответствующего точкам внутри полуострова. Более удивительным и на первый взгляд парадоксальным явился экспериментальный факт, указавший на то, что воспламенение можно вызвать, снижая давление смеси (стрелка вниз). Правда, дальнейшее снижение давления поведет к пересечению фигуративной точкой нижнего предела (I на рис. 2.16) и к выходу системы из области воспламенения.
Существование нижнего предела воспламенения было первоначально обнаружено для другой системы – пара фосфора и кислорода (первые наблюдения сделаны Жубером в 1847 г.). В 1926-27 гг. Н.Н. Семеновым, Ю.Б. Харитоном, З.Ф.Вальта, А.И. Шальниковым было установлено, что при давлении кислорода меньше некоторого минимального значения, пары фосфора не горят, причем нельзя констатировать даже следов реакции. Однако стоит лишь превысить предел давления кислорода, как происходит воспламенение. В данных экспериментах были установлены также и другие удивительные факты. Оказалось, что минимальное необходимое для воспламенения давление кислорода еще снижается при добавлении к горючей смеси инертного газа (добавки аргона как бы повышали реакционную способность кислорода). Минимальное давление кислорода, необходимое для воспламенения, снижалось также при увеличении размеров реакционного сосуда.
Позже, именно при исследовании системы водород – кислород, Гиншельвуд открыл существование верхнего предела самовоспламенения (II, рис. 2.16). Таким образом, постепенно были очерчены контуры полуострова, а также установлены подобные явления и в целом ряде других случаев реакций окисления.
Следует отметить еще один характерный момент, а именно: в области самовоспламенения быстрая реакция начинается обычно не сразу, а по истечении некоторого времени, называемого периодом индукции1, продолжительность которого для реакции окисления водорода составляет десятые доли секунды.
Цепная теория, начало развитию которой было положено в 1913 г., когда Боденштейн ввел понятие цепной реакции, дает объяснение всех перечисленных выше особенностей обсуждаемого класса реакций.
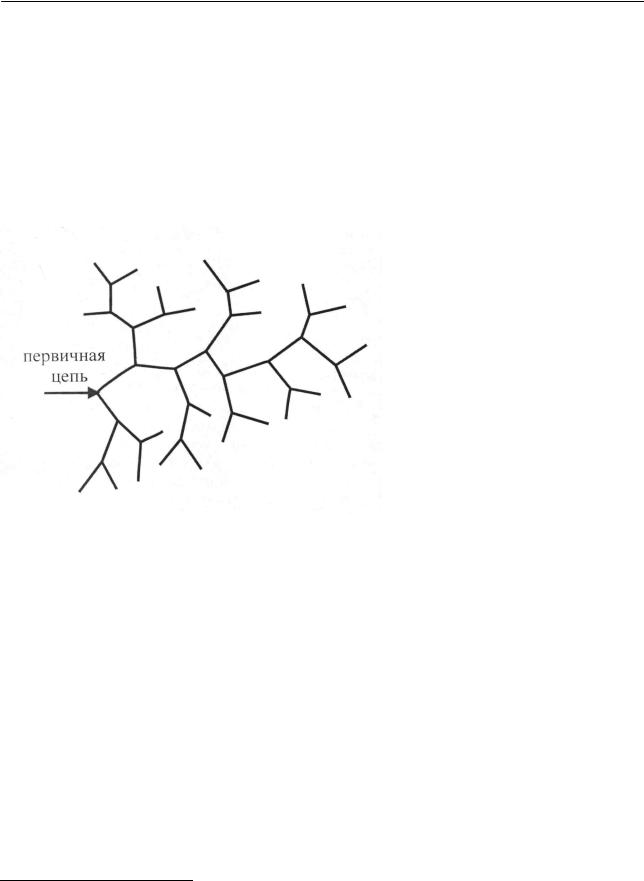
Цепные реакции могут быть с неразветвленными и разветвленными це-
пями. В каждой промежуточной элементарной стадии неразветвленной цепной реакции одна активная частица вызывает возникновение лишь одной активной частицы, что схематически показано на рис. 2.17 (а).
1 Напомним, что этот термин встречался ранее в связи с последовательными реакциями, а также применяется при описании явлений автокатализа.
64

Х и м и ч е с к а я к и н е т и к а
Рис. 2.17. Схемы неразветвленной (а) и разветвленной (б) цепных реакций
Если элементарная стадия цепной реакции приводит к увеличению числа активных частиц, то реакция относится к разветвленным. На рис. 2.17 (б) схематически представлена разветвленная цепь с удвоением числа активных частиц в каждом элементарном акте.
Любая цепная реакция состоит из трех основных стадий: зарождения, про-
должения и обрыва цепи.
Рассмотрим протекание реакции с неразветвленными цепями на примере реакции образования хлористого водорода из водорода и хлора:
H2 +Cl2 → 2HCl .
Встадии зарождения (инициирования) цепи образуются активные частицы. Зарождение цепи может быть вызвано различными причинами: распадом– молекулы и молекул на радикалы; гетерогенными условиями протекания реакции, в частности за счет участия стенок сосуда; инициирование извне, в том числе под действием света и ионизирующего излучения; добавками специальных веществ – инициаторов образования свободных радикалов.
Врассматриваемой реакции процессом зарождения цепи является реакция
Cl2 →Cl + Cl ,
т.е. диссоциации молекул хлора на свободные атомы, обладающие, как известно, повышенной реакционной способностью. Эта реакция может осуществляться различными путями:
– за счет стенок сосуда в условиях гетерогенной реакции
Cl2 Стенки→Сl + Cl ; сосуда
65

Х и м и ч е с к а я к и н е т и к а
– путем фотохимического инициирования
Cl2 hν →Cl + Cl ;
– термическим путем при столкновении, скажем, двух молекул хлора
JJ
Cl2 + Cl2 →Cl + Cl + Cl2
(здесь стрелка над молекулой хлора означает повышенное содержание энергии, затрачиваемой на диссоциацию);
– химическим путем при взаимодействии, например, с атомом натрия при введении паров последнего
Cl2 + Na → NaCl + Cl .
После стадии зарождения цепи следует стадия продолжения цепи, т.е. сама цепь. Данная стадия состоит из большого числа повторяющихся элементарных реакций взаимодействия активных частиц с исходными веществами. Для рассматриваемой нами реакции она включает следующие повторяющиеся элементарные реакции:
|
|
|
Cl + H2 |
→ HCl + H |
(2.176) |
|
. |
|
H + Cl2 |
→ HCl + Cl |
|
В результате возникает «цепь» реакций, которая при благоприятных условиях, например в отсутствии кислорода, может достичь многих тысяч звеньев.
Звеном цепи называют повторяющуюся совокупность элементарных стадий (реакций), которые начинаются образованием активной частицы и за-
канчиваются ее регенерацией. Две элементарных стадии реакции (2.176), ко-
торые определяют образование свободного атома водорода H и его регенерацию, т.е. переход в HCl, и есть звено неразветвленной цепной реакции. При
этом свободный атом хлора Cl , образующийся во втором элементарном акте, дает начало следующему звену. Таким образом, на одну первично активированную, скажем под действием света, молекулу Cl2 образуется не две молекулы
HCl, как это имело бы место при обычной бимолекулярной реакции, а сотни тысяч. Звено цепи может состоять из одной или нескольких элементарных ста-
дий. Поэтому в более общей форме звено цепи может быть определено как
цикл радикальных превращений с сохранением свободной валентности и регенерацией исходной частицы. Данное определение характеризует как звено (2.176) рассматриваемого нами процесса, так и, в отличие от первого опре-
деления, звено цепи, например, при радикальной полимеризации винилового мономера CH2 =CHX , состоящее из одной элементарной стадии:
R + CH2 = CHX → RCH2CHX ,
где R – макрорадикал.
66

Х и м и ч е с к а я к и н е т и к а
Третья стадия цепной реакции связана с обрывом цепи («гибель» активных частиц). На этой стадии активные валентно–ненасыщенные частицы превращаются в валентно–насыщенные или, по крайней мере, в частицы не способные к продолжению цепи. Обрыв цепи происходит путем захвата активных частиц стенками реакционных сосудов, третьими частицами, а также другими путями, в частности при взаимодействии (рекомбинации) активных частиц. Таким образом, в рассматриваемой системе кроме написанных выше реакций зарождения и продолжения цепи могут протекать также следующие процессы, выводящие из системы активные частицы и ведущие к прекращению развития цепи, т.е. к ее обрыву:
|
H + H + M → H2 + M |
|
|
|
H + H + S → H2 |
+ S |
, |
|
|
+ M (S ) |
|
Cl + Cl + M (S )→Cl2 |
|
||
|
|
|
|
H + Cl + M (S )→ HCl + M (S ) |
|
||
где M и S обозначают третью частицу или стенку сосуда.
В результате существования обрыва цепей число звеньев в каждой цепи, называемое длиной цепи, конечно. Естественно, что в ходе реакции в системе развиваются цепи различной длины – от очень коротких до очень длинных. Тем не менее, при данных условиях реакцию можно охарактеризовать средней длиной цепи L, зависящей от очень многих факторов – температуры, давления, примесей, формы сосуда и состояния его стенок и т д.
Рассмотренный цепной механизм позволяет понять многие уже отмечавшиеся особенности обсуждаемого класса реакций.
Небольшое количество добавок, способствующих зарождению цепей, например паров натрия в смеси водорода и хлора, могут вызвать очень большой эффект, так как на каждый атом добавки может прореагировать в среднем после стадии
Cl2 + Na → NaCl + Cl
до сотни тысяч молекул водорода и хлора.
Велико может быть действие тормозящих реакцию добавок (ингибито-
ров). Молекула ингибитора, например кислорода, при реакции водорода с хлором может, захватив атом водорода
H + O2 + M → HO2 + M
и образовав малоактивный радикал HO2 , оборвать цепь в самом начале, что
приведет к уменьшению количества продуктов реакции опять же на сотню тысяч.
Торможение реакции при увеличении соотношения S/V сосуда также находит объяснение на основании цепного механизма. Известно [9, 12], что реакции
67

Х и м и ч е с к а я к и н е т и к а
типа рекомбинации атомов водорода практически не идут бимолекулярно, но осуществляются при тройном ударе или на стенке сосуда. Активные частицы, диффундируя к стенке сосуда, гибнут на ней и цепи обрываются:
H + H + S → H2 + S .
Роль стенок особенно возрастает при низких давлениях реагирующих газов, когда диффузия активных частиц к стенкам облегчена вследствие уменьшения числа столкновений. Естественным представляется уменьшение роли стенок при увеличении размеров сосуда (уменьшение S/V) – именно с этим связано отмечавшееся выше снижение минимально необходимого давления кислорода при воспламенении паров фосфора в случае увеличения размеров реакционного сосуда. Добавление инертного газа, не участвующего непосредственно в реакции (He, Ar, Ne), но препятствующего диффузии активных частиц к стенкам, должно препятствовать и обрыву цепей на стенках – именно с этим связано отмечавшееся выше снижение минимально необходимого давления кислорода при воспламенении паров фосфора при добавлении аргона к смеси фосфора и кислорода.
В реагирующей системе при высоких давлениях газа затрудняется диффузия к стенкам, а, следовательно, обрыв цепей на стенках не играет существенной роли. В то же время, повышение давления увеличивает роль тройных соударений в объеме, которые также ведут к гибели активных частиц и обрыву цепи. Сюда относятся процессы типа
H+ H + M → H2 + M ,
атакже приведенный выше процесс образования радикала HO2 . Отношение тройных столкновений к двойным (Z3 / Z2 ) возрастает пропорционально давле-
нию газа. Поэтому с повышением давления значение тройных столкновений в обрыве цепей увеличивается.
Существование пределов (I и II) воспламенения и всего полуострова воспламенения (рис.2.16) объясняется именно обрывом цепей на стенках и в объеме. Однако и пределы, и полуостров относятся уже к цепным реакциям другого класс – к разветвленным цепям, свойственным самоускоряющимся реакциям окисления.
Уже из данных выше определений явствует, что в отличие от неразветвленных цепных реакций, где в процессах продолжения цепи на одну вступающую в реакцию частицу возникает также единственная частица другого сорта, в разветвленных цепях имеет место увеличение числа активных частиц. Так, на стадии продолжения цепи при окислении водорода – реакции гремучего газа – протекают, в частности, процессы
H + O2 |
|
|
|
|
→OH + O |
, |
(2.177) |
||
|
|
|
||
O + H2 |
→OH + O |
|
|
|
68
Х и м и ч е с к а я к и н е т и к а
в которых вместо одного вступающего в реакцию атома появляются две активные частицы – одна может продолжать цепь, а другая – начать новую. Таким образом, имеет место разветвления цепи. Если оно осуществляется часто, то даже одна первоначально возникшая цепь может привести к развитию многих цепей. В предельном случае можно представить, что разветвление происходит в каждом звене, и тогда говорят о сплошь разветвленной цепной реакции. При частых разветвлениях развитие химической реакции может носить лавинообразный характер, условно изображенный на рис.2.18. В этом случае скорость
Рис. 2.18. Лавинообразное развитие разветвленной цепной реакции
реакции, даже при малом первоначальном числе активных частиц, или первичных цепей, может быстро возрасти, и процесс завершится самовоспламенением или взрывом, что и происходит внутри области воспламенения.
Взрывом называется процесс быстрого выделения энергии, связанного с внезапным изменением состояния вещества, в результате чего в среде образуется ударная или взрывная волна. Возникновение цепного воспламене-
ния или взрыва1, как видно из предыдущего изложения – результат лавинообразного нарастания числа активных частиц (свободных радикалов) при постоянной температуре вследствие протекания разветвленной цепной реакции.
Нижний и верхний пределы воспламенения находят следующее качественное объяснение. При давлениях, меньших соответствующих нижнему пределу, активные частицы легко диффундируют к стенкам сосуда, где и гибнут. Обрыв цепей на стенках преобладает над разветвлением и быстрая реакция не развивается. По мере повышения давления диффузия к стенкам становится все более затрудненной, а число двойных столкновений типа (2.177), ведущих к разветв-
1 Цепной взрыв следует отличать от теплового взрыва, который возникает при обычной (не цепной) экзотермической реакции, когда выделение теплоты при химической реакции становится больше теплоотдачи.
69

Х и м и ч е с к а я к и н е т и к а
лению цепей, возрастает. При давлениях выше определенного критического (нижний предел I) зарождение и разветвление цепей начинает преобладать над обрывом. В результате реакция самоускоряется и может закончиться воспламенением или взрывом. Считается, что именно такое явление и имеет место внутри полуострова воспламенения.
При дальнейшем повышении давления все бóльшую роль начинают играть процессы обрыва цепей в объеме, как результат возрастающей роли тройных соударений. При окислении водорода существенное значение имеет и уже от-
мечавшаяся реакция образования малоактивного радикала HO2 . Если давление
превышает значение, соответствующее верхнему пределу (II, рис. 2.16), обрыв преобладает над размножением цепей и возможность развития быстрой реакции исчезает.
Воспламенению горючей смеси внутри полуострова предшествует индукционный период. Теория разветвленных цепей объясняет это тем, что сначала число цепей может быть очень мало и реакция незаметна вследствие недостаточной чувствительности метода анализа. По истечении некоторого времени τинд число цепей возрастает в громадной степени вследствие упоминавшегося
лавинообразного размножения и следует воспламенение или взрыв. Для этого случая теория дает следующую зависимость скорости реакции от времени:
v = A(eϕτ −1), |
(2.178) |
где A и ϕ – постоянные, характеризующие реакцию и зависящие от ряда условий. На рис. 2.19 функция (2.178) представлена графически. Здесь при анализе следует учитывать, что в выводе v = f (τ) не учитывалось уменьшение концен-
трации исходных веществ вследствие выгорания, поэтому стремлению скорости к бесконечности с течением времени не следует придавать какого-либо физического смысла. Скорость действительно становится очень большой, но не бесконечной.
Рис. 2.19. Зависимость от времени скорости разветвленной цепной реакции внутри полуострова воспламенения
70
