
Физ химия и физ т.д
..pdf
Х и м и ч е с к а я к и н е т и к а
В кинетические уравнения (2.37) входит отношение исходной с0 и теку-
щей с концентраций, что позволяет при исследовании кинетики реакций использовать не абсолютные значения концентраций, а относительные величины, например, процентное содержание прореагировавшего вещества, интенсивность светорассеяния, оптическую плотность (как в случае выполняемой студентами лабораторной работы по исследованию кинетики взаимодействия малахитового зеленого с гидроксид-ионом [15]) и др.
Если необходимо определить убыль концентрации x за время τ , то с уче- |
|
том c = c0 − x , из (2.37) имеем |
|
x = c0 (1 − e−kτ ). |
(2.40) |
Кинетическое уравнение для простой (элементарной) реакции второго порядка в случае, когда реагируют одинаковые молекулы1 (в общем случае – одинаковые частицы) и c1 = c2 = c (2.17), имеет следующий вид:
|
|
|
|
−dc / dτ = kc2 . |
|
|
(2.41) |
|||
Как и в случае реакций первого порядка (2.35), |
(2.36) |
разделим перемен- |
||||||||
ные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
kdτ = − dc |
|
|
(2.42) |
|||
и проинтегрируем уравнение (2.42) |
c2 |
|
|
|
||||||
в пределах от 0 до τ и от c0 до с |
||||||||||
|
|
|
|
τ |
c |
|
|
|
||
|
|
|
|
∫kdτ =∫− dc2 . |
|
|
(2.43) |
|||
|
|
|
|
0 |
|
c |
|
|
|
|
|
|
|
|
c0 |
|
|
|
|||
Получим |
|
|
|
|
|
|
|
|
|
|
1 |
1 |
|
1 |
1 |
|
c0 − c |
= kτ. |
(2.44) |
||
c |
− |
|
= kτ, |
с |
= kτ + |
|
, |
|
||
c |
c |
c c |
||||||||
|
0 |
|
|
0 |
|
0 |
|
|
||
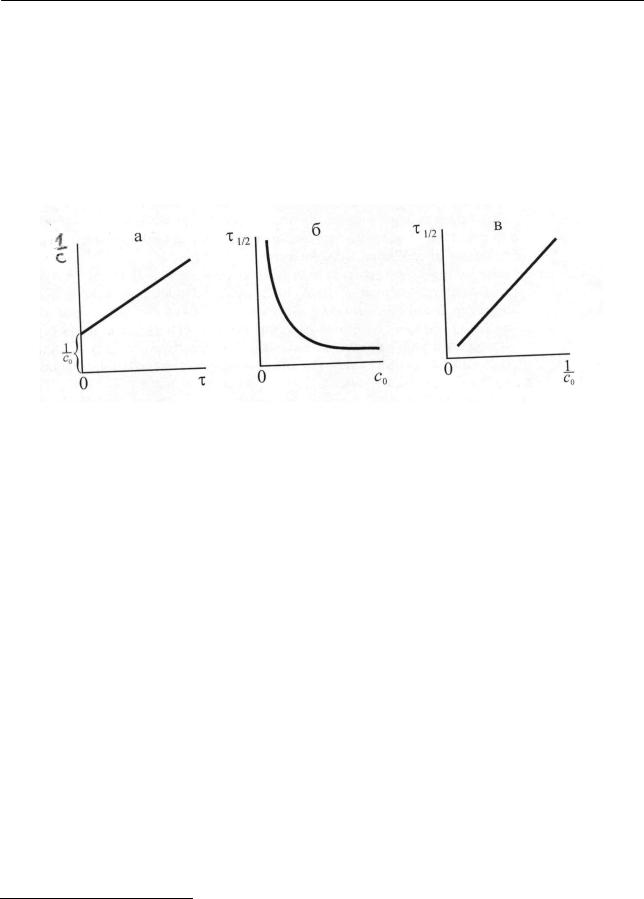
В соответствии с (2.44) величина 1с прямо пропорциональна времени, что отражает рис. 2.4 (а).
1 Получаемые здесь результаты могут быть распространены на формально простые реакции второго порядка по одному из реагирующих веществ в предположении, что по другому веществу порядок реакции равен нулю (оно находится, например, в избытке), а также и по отношению реакций, в которых с равными стехиометрическими коэффициентами участвуют две различные частицы, находящиеся в реакционном пространстве в равных начальных концентрациях..
21
Х и м и ч е с к а я к и н е т и к а
Уравнение (2.44) позволяет определить время полупревращения и констан-
ту скорости: |
|
|
|
|
|
τ1/ 2 = |
1 |
, k = |
1 |
. |
(2.45) |
|
|
||||
|
kc0 |
τ1/ 2c0 |
|
||
Итак, для реакций второго порядка время полупревращения [уравнение, (2.45) рис. 2.4 (б), (в)] и константа скорости реакции (2.45) обратно про-
порциональны начальной концентрации с0 .
Рис. 2.4. Зависимость концентрации от времени процесса (а) и времени полупревращения от начальной концентрации (б), (в) для реакции второго порядка
Если необходимо определить убыль концентрации x вещества за время
τ, то с учетом c = c0 − x, из (2.44) имеем
x = c0 |
|
|
1 |
|
|
(2.46) |
|
1 |
− |
|
. |
||||
kτc0 +1 |
|||||||
|
|
|
|
|
|||
Кинетическое уравнение для элементарной реакции третьего порядка в
случае, когда с1 = с2 = с3 = с1 (2.20), представляется в следующем виде:
− dc |
= kc3. |
(2.47) |
dτ |
|
|
Разделив переменные |
|
|
kdτ = − dc |
(2.48) |
|
|
c3 |
|
и проинтегрировав уравнение (2.48) в пределах от 0 до τ и от c0 |
до с |
|
1 При участии в реакции трех различных частиц подразумевается, что они реагируют с равными стехиометрическими коэффициентами.
22

Х и м и ч е с к а я к и н е т и к а
|
|
|
|
|
τ |
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
∫kdτ = −∫dc3 , |
|
|
|
|
|
(2.49) |
|||
|
|
|
|
|
0 |
|
c |
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
получим |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
− |
1 |
= k τ , |
1 |
= |
2 k τ + |
1 |
, |
kτ = |
c2 − c2 |
(2.50) |
|||
|
2 с 2 |
2 с 2 |
|
с 2 |
c 2 |
2c2c2 . |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
0 |
|
|
|
|
|
0 |
|
|
0 |
|
|
В соответствии с (2.50) величина с12 прямо пропорциональна времени
реакции, что отражает рис. 2.5 (а).
Уравнение (2.50) позволяет определить время полупревращения и константу скорости:
τ |
1/ 2 |
= |
3 |
, k = |
|
3 |
|
. |
(2.51) |
|
2kc2 |
2τ |
1/ 2 |
c2 |
|||||||
|
|
|
|
|
||||||
|
|
|
0 |
|
|
0 |
|
|
Итак, для реакций третьего порядка время полупревращения [уравнение, (2.51) рис. 2.5 (б), (в)] и константа скорости реакции (2.51) обратно про-
порциональны квадрату начальной концентрации сo2 .
Рис. 2.5. Зависимость концентрации от времени процесса (а) и времени полупревращения от квадрата начальной концентрации (б), (в) для реакций третьего порядка
Если необходимо определить убыль концентрации x вещества за время
τ, то с учетом c = c0 − x, из (2.50) имеем
|
|
|
1 |
|
|
|
x = c |
1 |
− |
|
(2.52) |
||
|
||||||
0 |
|
|
1 + 2kc2τ |
|
||
|
|
|
0 |
|
|
|
Полученные для реакций различного порядка кинетические уравнения устанавливают связь между параметрами, характеризующими течение химиче-
23

Х и м и ч е с к а я к и н е т и к а
ской реакции (k,c0 ,c,τ ), в случаях, когда порядок реакции известен. Если же порядок реакции неизвестен, то его необходимо определить.
2.2.1.4. Методы измерения скоростей реакций и способы определения порядка реакции1
В соответствии с определением понятия (см. 2.2.1.2) измерение скорости реакции сводится к определению зависимости концентрации веществ от времени. Данная задача решается с помощью наиболее подходящих для изучаемого случая методов количественного анализа.
Условно аналитические методы, применяемые в кинетике, можно разделить на химические и физические. Химический анализ позволяет непосредственно определить концентрации одного из реагирующих веществ или продуктов. В то же время, необходимость быстро сопоставлять результаты с изучаемой реакцией создает определенные трудности в его применении. Поэтому, когда скорость аналитической процедуры слишком мала, приходится прибегать к остановке реакции (ее «замораживанию») путем резкого изменения какого-либо условия2 (понижение температуры, удаление катализатора, добавка ингибитора и т.д.). Преимущество химических методов анализа – получение абсолютных значений концентраций.
Физические методы анализа, основанные на измерении какого-либо физического свойства реакционной смеси, изменяющегося в ходе реакции, обычно удобнее химических. Базируются они на имеющем обычно место наличии существенных различий во вкладах в измеряемое свойство исходных веществ и продуктов реакции. Теоретически для слежения за ходом реакции можно использовать любое достаточно изменяющееся свойство. Наибольшее распространение нашли методы, связанные с измерением давления при газовой реакции, дилатометрия, различные оптические и электрические методы.
К преимуществам физических методов анализа следует отнести: быстроту, возможность получения большего числа экспериментальных точек в данный промежуток времени, отсутствие необходимости отбора пробы и связанных с этой операцией ошибок, отсутствие влияния на состояние системы, возможность применения непрерывной автоматической записи изменений свойства. Однако физические методы не дают непосредственно абсолютных значений концентраций. Кроме того, могут появиться ошибки, связанные с самой реакцией. Так, например, при спектроскопическом изучении малые количества сильно окрашенных загрязнений или побочных продуктов могут совершенно исказить картину. Поэтому для полного изучения какой-либо реакции следует
1Помимо рассматриваемых нами известны и другие способы определения порядка реакции
(см., например, [9, 12]).
2Влияние различных факторов на скорости химических реакций подробно рассматривается в последующем изложении.
24

Х и м и ч е с к а я к и н е т и к а
применять не один, а несколько методов. Особенно желательно это при необ-
ходимости проверки стехиометрии изучаемой реакции. |
|
|
Рассмотрим формально простую реакцию n1-го порядка по |
A1 и n2 -го по- |
|
рядка по A2 : |
|
|
nA A1 |
+ nA A2 → Продукты. |
(2.53) |
1 |
2 |
|
Для данной реакции, исходя из изложенного в 2.2.1.1 и 2.2.1.2, можно
сформулировать нижеследующее. |
|
|
|
|
|
|
|
||
Зависимость скорости реакции ( |
2.53) от концентрации исходных веществ |
||||||||
описывается выражением |
|
|
|
|
|
|
|
|
|
v = |
1 |
|
|
dc1 |
= kcn1cn2 |
, |
(2.54) |
||
(−nA )dτ |
|||||||||
|
1 |
2 |
|
|
|||||
|
|
|
|
|
|||||
|
1 |
|
|
|
|
|
|
|
|
где c1 и c2 - концентрации A1 и A2 .
Общий порядок реакции равен сумме порядков реакции по отдельным ис-
ходным веществам: |
|
n = n1 + n2 . |
(2.55) |
Если реакция (2.53) элементарная или формально простая, но подчиняю-
щаяся кинетическому уравнению для элементарной реакции, то порядок реакции по веществам A1 и A2 равен стехиометрическим коэффициентам в уравне-
нии, а общий порядок равен их сумме:
n = nA |
+ nA . |
(2.56) |
1 |
2 |
|
Практически удобно сначала определить порядок реакции по отдельным веществам, а затем общий порядок реакции по уравнению (2.55).
Обычно, для того чтобы скорость реакции в уравнении (2.54) в явном виде
зависела только от концентрации одного из исходных веществ, используют способ избыточных концентраций (метод изоляции, или метод избытка).
А. Способ избыточных концентраций Данный способ заключается в том, что проводят серии опытов, в каждой из
которых изучается влияние изменения концентрации только одного из исходных веществ на скорость реакции. Это достигается применением всех остальных исходных веществ в данной серии опытов в таком избытке, что расход их в ходе реакции не меняет существенно их концентраций, которые поэтому можно считать постоянными.
Применительно к рассматриваемой реакции (2.53) данный способ реализу-
ется следующим образом.
На первом этапе проводят реакцию при избыточной концентрации вещества A2 по сравнению с веществом A1 , считая, что при протекании реакции меняется
25

Х и м и ч е с к а я к и н е т и к а
только концентрация вещества A1 , в то время как концентрация вещества A2 остается практически постоянной и ее можно ввести в постоянный коэффициент. Уравнение (2.54) при этом примет вид
− |
dc1 |
= k cn1 |
, |
(2.57) |
||||
dτ |
||||||||
|
|
|
1 |
1 |
|
|
||
где |
|
|
|
|
|
|
||
k = n |
A |
kcn2 |
|
(2.58) |
||||
1 |
|
|
02 |
|
|
|||
|
|
|
1 |
|
|
|
|
|
( с02 – начальная концентрация вещества A2 ).
На втором этапе проводят реакцию при избытке концентрации вещества A1 по сравнению с веществомA2 . Уравнение (2.54) в этом случае преобразуется к виду
− |
dc2 |
= k2c2n2 , |
(2.59) |
|||||
dτ |
||||||||
|
|
|
|
|
||||
где |
|
|
|
|
|
|
||
k |
2 |
= n |
A |
kcn1 |
(2.60) |
|||
|
|
|
|
01 |
|
|||
|
|
|
|
|
2 |
|
|
|
( с01 – начальная концентрация вещества A1 ).
После выполнения данных экспериментов одним из рассматриваемых ниже способов проводят расчет порядка реакции по данному исходному компоненту, и затем определяют общий порядок реакции. Уравнения (2.57) и (2.59) позво-
ляют вычислить k1 и k2 , а затем, исходя из (2.58) и (2.60), рассчитать константу скорости реакции
k = |
|
k1 |
= |
|
k2 |
. |
(2.61) |
||
n |
n |
n |
n |
||||||
|
|
c 2 |
A |
c 1 |
|
||||
|
|
A 02 |
|
|
01 |
|
|
||
|
|
1 |
|
|
|
2 |
|
|
|
Способы расчета порядка реакции по данному веществу подразделяют на дифференциальные и интегральные.
В. Дифференциальный способ По данному способу, как правило, производят графическое дифференциро-
вание экспериментально полученной кинетической кривой путем проведения касательных в разных точках к ней. Как уже отмечалось (см. 2.2.1.1), скорость реакции по данному веществу в данный момент времени численно равна тангенсу угла наклона касательной к кинетической кривой. На основании полученных таким образом данных для зависимости скорости реакции от времени и проводят расчеты.
26

Х и м и ч е с к а я к и н е т и к а
Способ логарифмирования. Пусть зависимость скорости реакции по первому веществу [см. уравнение (2.57)]от времени при избыточных концентра-
циях всех других исходных веществ выражается уравнением
v |
(1) = − |
dc1 |
= k cn1 |
, |
(2.62) |
|
dτ |
||||||
|
|
1 1 |
|
|
где n1- порядок реакции по первому веществу. Прологарифмируем это выражение:
lnv(1) = ln k |
+ n ln c . |
(2.63) |
|
1 |
1 |
1 |
|
В случае справедливости уравнений (2.62), (2.63) на графике в координатах
lnv(1) − ln c1 опытные точки для разных моментов времени должны располо-
житься на прямой линии. Отрезок, отсекаемый ею на оси ординат на этом графике, дает значение ln k1 , а тангенс угла наклона прямой равен порядку реакции
n1 по первому веществу. При таком расчете порядок реакции по веществу мо-
жет получиться и нецелочисленным. Если точки, найденные по опытным данным для кинетической кривой, не располагаются на прямой, то это указывает на несоответствие уравнений (2.62) и (2.63) опытным данным, т.е. на то, что
скорость реакции зависит от концентрации рассматриваемого вещества по более сложной зависимости, чем степенной закон.
Достоинством дифференциальных способов, один из которых нами рассмотрен, является простота расчета. В то же время, эти способы характеризуются большой погрешностью при оценке тангенса угла наклона касательной в разных точках кинетической кривой, и, следовательно, большой погрешностью при оценке скорости реакции, что является их основным недостатком. Более точные результаты дают интегральные способы.
С. Интегральные способы В этих способах для расчетов используют уравнения кинетических кривых,
полученные после интегрирования уравнений вида
− dc |
= kcn , |
(2.64) |
dτ |
|
|
или |
|
|
kdτ = − dc . |
(2.65) |
|
|
cn |
|
При всех рассматриваемых способах расчета опытные данные получают по зависимости концентрации рассматриваемого вещества от времени в условиях избыточных концентраций всех исходных веществ, кроме исследуемого. В
27

Х и м и ч е с к а я к и н е т и к а
дальнейших выкладках для упрощения, например, в уравнении (2.57), вместо k1 и c1 будем писать просто k и c .
Рассмотрим четыре интегральных способа. Первые два способа можно применять только в случае целочисленных значений порядка реакции по данному веществу. Исходной предпосылкой этих способов являются экспериментальные данные об изменении во времени концентрации исходных реагирующих веществ, т.е. τ1 − с1 , τ2 − с2 ,…, τi − ci , при известной начальной концен-
трации c0 .
Способ подстановки. В этом способе необходимо обратиться к уравнениям (2.37), (2.44) и (2.50). Подставляя в них экспериментальные значения концен-
траций реагирующих веществ за различное время, рассчитывают константы скорости реакции. Свидетельством того, что экспериментальные данные характерны для реакции, порядок которой определяется соответствующим уравнением, служит постоянство константы скорости реакции для различных значений
с = f (τ ).
Графический способ. Он основан на зависимости с = f (τ ) [см. рис. 2.1 (прямая 2), 2.3 (а), 2.4 (а), 2.5 (а)]. В соответствии с уравнениями (2.31), (2.37), (2.44)и (2.50) эта зависимость для реакций нулевого (0), первого (1), второго (2) и третьего (3) порядков выглядит следующим образом:
(0) |
с = −kτ + c0 ; |
(1) |
ln c = −kτ + ln c0; |
|||||||
|
|
|
|
|
|
|
|
(2.66) |
||
(2) |
1 = kτ + |
1 |
; |
(3) |
|
1 |
= 2kτ + |
|
1 |
. |
|
|
|
||||||||
|
c |
c |
|
|
c2 |
|
c2 |
|||
|
|
0 |
|
|
|
|
|
0 |
|
|
Зависимость между c и τ , согласно выражениям ( |
2.66) и рис. 2.1 (прямая |
|||||||||
2), 2.3 (а), 2.4 (а), 2.5 |
(а), будет прямой линией, но в разных координатах для |
|||||||||
разных порядков1: нулевого c −τ [рис. 2.1 (прямая 2)], первого ln c −τ [рис. 2.3
(а)], второго 1/ с −τ [рис. 2.4 (а)] и третьего 1/ c2 −τ [рис. 2.5 (а)]. Если построенный по экспериментальным данным график оказался линейным, например, в координатах 1/ с −τ , реакцию следует считать реакцией второго порядка.
Исходя из вышесказанного понятно, что после установления порядка реакции, т.е. после получения линейной зависимости в соответствующих координатах, не представляет сложности определить графически величину константы
1 Уравнения (2.66) свидетельствуют о возможности использования и других координат. На-
пример, в координатах (c0 −c)−τ , ln |
c |
−τ , |
|
1 |
− |
1 |
|
−τ , |
|
1 |
− |
1 |
|
−τ , соответственно для |
|
0 |
|
|
|
|
|
|
|
|
|
||||||
c |
|
|
|
2 |
2 |
||||||||||
|
|
c |
|
c0 |
|
c |
|
|
c0 |
|
|
||||
реакций нулевого, первого, второго и третьего порядков, также имеем прямую линию, но исходящую из начала координат.
28

Х и м и ч е с к а я к и н е т и к а
скорости реакции. Действительно, в выражениях (2.66) величины −k , −k , +k
и +2k являются угловыми коэффициентами, а, следовательно, численно равны тангенсам углов наклона прямых к оси времени (ось абсцисс) соответственно для реакций нулевого, первого, второго и третьего1 порядков.
Способ определения времени полупревращения. Нахождение порядка реакции по времени полупревращения в соответствии с формулами (2.32),
(2.39), (2.45), (2.51) основано на зависимости τ1/ 2 от начальной концентра-
ции. По серии опытных данных для различных начальных концентраций находят время полупревращения исходного вещества, т.е. c0′ −τ1/′ 2 , c0′′ −τ1/′′2 ,…,
c0i −τ1/i 2 .
Процесс соответствует нулевому порядку, если время полупревращения в соответствии с уравнение (2.32) пропорционально начальной концентрации.
Согласно выражению (2.39) независимость времени полупревращения от на-
чальной концентрации исходного вещества указывает на первый порядок химической реакции. В случае, когда подтверждается справедливость уравнения(2.45), т.е. время полупревращения обратно пропорционально начальной
концентрации, то реакция имеет второй порядок. Обратная пропорциональность периода полупревращения квадрату начальной концентрации свидетельствует о третьем порядке реакции в соответствии с уравнением(2.51). Когда
порядок реакции нецелочисленный, то в рамках данного способа лучше применить следующий прием. Обобщая уравнения (2.32), (2.39), (2.45) и (2.51) для
любого n получим
τ |
1/ 2 |
= const |
, |
(2.67) |
|
cn−1 |
|
|
|
|
|
0 |
|
|
где const
c0 и τ1/ 2
жение
зависит от n . Прологарифмировав это уравнение при двух значениях (при данном n ) и вычтя из второго уравнения первое, получим выра-
n = |
lgτ1/′′2 − lgτ1/′ 2 |
+1. |
(2.68) |
|
lg c0′′ − lg c0′ |
||||
|
|
|
1При |
представлении зависимости |
c = f (τ) |
для |
реакций |
третьего порядка |
в виде |
||||
1/ 2c2 |
= kτ +1/ 2c2 , т.е. графически в координатах 1/ 2c2 −τ , угловым коэффициентом, чис- |
|||||||||
|
0 |
|
к оси времени, является величина k. |
|
||||||
ленно равным тангенсу угла наклона прямой |
Если по |
|||||||||
оси ординат отложены значения −c , |
−ln c , − |
1 , |
− |
1 |
или − |
1 |
, то знаки угловых коэффи- |
|||
c2 |
2c2 |
|||||||||
|
|
|
c |
|
|
|
|
|||
циентов, а, следовательно, и направления прямых на графиках, меняются на противоположные.
29

Х и м и ч е с к а я к и н е т и к а
Уравнение (2.68) позволяет определить порядок реакции, если известно
время полупревращения при двух различных начальных концентрациях вещества.
Способ Эмануэля – Кнорре. Интегрирование уравнения (2.65) в пределах от 0 до τ и от с0 до с приводит к выражению
|
kτ = |
1 |
|
|
1 |
|
− |
|
1 |
|
, |
(2.69) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
n − |
1 |
cn−1 |
cn−1 |
|||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
||||
или вынося за скобки 1/ сn−1 |
и обозначая |
|
|
|
|
|
|
|
|
|
|
|
|||||||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c |
|
|
n−1 |
|
|
|
(2.70) |
|||||||
|
|
z = |
|
|
|
|
|
|
, |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
c0 |
|
|
|
|
|
|
|
|||||||||
получаем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
kτ = |
|
|
1 |
|
|
|
|
|
|
|
1 |
|
|
|
(2.71) |
|||
|
|
|
|
|
|
|
|
|
|
|
−1 . |
||||||||
|
(n −1)c |
n−1 |
|||||||||||||||||
|
|
|
|
|
|
z |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
||||
Запишем уравнение (2.71) для двух значений τ и z |
и разделим второе вы- |
||||||||||||||||||
ражение на первое: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
τ′′ |
|
|
|
|
1 |
|
−1 |
|
|
|
|
|
|
||||
|
|
= |
|
|
|
z′′ |
. |
|
|
|
(2.72) |
||||||||
|
|
τ′ |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
1 |
|
−1 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
z′ |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
На опытной кинетической кривой выберем такие две точки, чтобы с′′ = (с′)2
или, соответственно, z′′ = (z′)2 . Тогда из уравнения |
(2.72) получим |
||||||||
|
τ′′ |
= |
1 |
+1. |
|
|
(2.73) |
||
|
|
τ′ |
|
|
|
||||
|
|
|
z′ |
|
|
|
|||
Подставляя значение z из выражения |
(2.70) |
в (2.73) и учитывая, что |
|||||||
с/ с0 =1 − β , где β |
– степень превращения |
исходного вещества, т.е. доля ис- |
|||||||
ходного вещества, |
превратившегося в продукт реакции (β = x / c0 ), из (2.73) |
||||||||
получаем |
|
|
|
|
|
|
|
|
|
|
|
|
lg τ′/ (τ′′ −τ′) |
|
|||||
|
n =1 + |
|
|
|
|
. |
(2.74) |
||
|
|
|
|
|
|||||
|
|
|
|
lg(1 − β′) |
|
||||
Зная τ′,τ′′ и β′, рассчитываем n.. При этом не имеет значения, является ли n целочисленным или нецелочисленным.
30
