
Физ химия и физ т.д
..pdf
Х и м и ч е с к а я к и н е т и к а
Данная задача чрезвычайно трудоемка, и поэтому обычно пользуются адиабатическим приближением. Оно основано на возможности разделения движений по различным степеням свободы, если масштабы характеристических времен этих движений существенно разные.
Масса любого ядра более чем в 103 раз превышает массу электронов. Следовательно, характеристические времена движений электронной и ядерной подсистем будут существенно различаться, т.е. изучение электронов можно проводить при любом фиксированном положении ядер. При изменении положения ядер электронное движение как бы безинерционно следует за движением ядер, т.е. любому расположению ядер в молекуле отвечает определенное распределение электронной плотности между ядрами. При этом структура потенциального поля в реагирующей системе будет функцией пространственных координат, определяющих расположение ядер в молекулах.
Как было отмечено, мы будем вести рассмотрение в рамках адиабатическо-
го приближения, что допустимо для электронно-адиабатических процессов,
т.е. процессов, которые происходят без изменения электронного состояния системы. В рамках этого приближения каждому i-му электронному состоянию1 системы отвечает единственная функция потенциальной энергии, которая зависит от координат ядер. Как известно [2], если система состоит из n атомов, то при неколлинеарной конфигурации эта функция зависит от 3n − 6 независимых переменных. Это следует из того, что из числа координат атомов 3n надо вычесть шесть степеней свободы, относящихся к движению системы как целого (3 поступательные и 3 вращательных степени свободы). Уравнение
Eпот = f (x1, x2 , …, x3n−6 ), |
(2.309) |
где x1, x2 , …, x3n−6 – координаты, определяющие расположение ядер в простран-
стве, задающее поверхность в пространстве размерности 3n − 6 , называют
уравнением поверхности потенциальной энергии.
Топография поверхности потенциальной энергии (ППЭ) зависит от при-
роды сталкивающихся частиц. На ней имеются максимумы, минимумы, перевалы, долины и т.д. ППЭ может зависеть от многих переменных, и это затрудняет представление ее в наглядном виде. Для упрощения рассмотрим столкновение атома А с двухатомной молекулой ВС. При таком столкновении могут происходить различные элементарные процессы. Ограничимся рассмотрением прямой обменной реакции
A + BC → AB + C . |
(2.310) |
Потенциальная энергия этой системы зависит от трех координат: расстояния между атомами В и С (rBC ), расстояния от атома А до центра масс молеку-
лы ВС (rA ) и угла β [рис. 2.36 (а)]. Для уменьшения числа координат зафикси-
1 Дальнейшее рассмотрение проводится для основного электронного состояния. Поэтому индекс «i» опускается или, в некоторых случаях, заменяется индексом «0».
141

Х и м и ч е с к а я к и н е т и к а
руем значение β, β =π , т.е. будем рассматривать коллинеарное столкновение
[рис. 2.36 (б)]. В этом случае потенциальная энергия зависит только от двух координат: rBC и rA . Вместо rA можно выбрать другую координату, например рас-
стояние rAB между атомами А и В.
Рис. 2.36. Относительное расположение трех взаимодействующих атомов при неколлинеарной (а) и коллинеарной (б) конфигурации
Согласно теории активированного комплекса механизм реакции (2.310), схематически изображенный на рис. 2.37, заключается в сближении атома А с
молекулой ВС, |
в процессе которого ослабляется связь В – С и возникает связь |
А – В. Процесс |
завершается образованием молекулы АВ и атома С, для чего |
система должна пройти через активированный комплекс (ABC )≠ , когда атом В в одинаковой степени принадлежит молекулам ВС и АВ:
A + BC →(ABC )≠ → AB + C . |
(2.311) |
Рис. 2.37. Схематическое изображение механизма реакции (2.310):
rAB > rBC′ , rBC < rBC′
142
Х и м и ч е с к а я к и н е т и к а
Изменения потенциальной энергии в ходе протекания реакции с учетом принятых выше координат, функцией которых является потенциальная энергия, могут быть представлены трехмерной диаграммой, на двух осях которой наносят соответственно координаты rAB и rBC , а на третьей – отвечающую им энер-
гию1. Трехмерную диаграмму можно заменить двухмерной, если на горизонтальную плоскость, ограниченную координатами rAB и rBC , нанести линии рав-
ной энергии – изоэнергетические линии, представляющие собой проекции сечения энергетической поверхности плоскостями, перпендикулярными к оси энергии. Данный метод изображения трехмерной поверхности на плоскости является принятым в орографии2 методом горизонталей, в соответствии с которым поверхность рассекают равноудаленными горизонтальными плоскостями и проецируют контуры сечения на плоскость. Поэтому изоэнергетические линии часто называют также горизонталями.
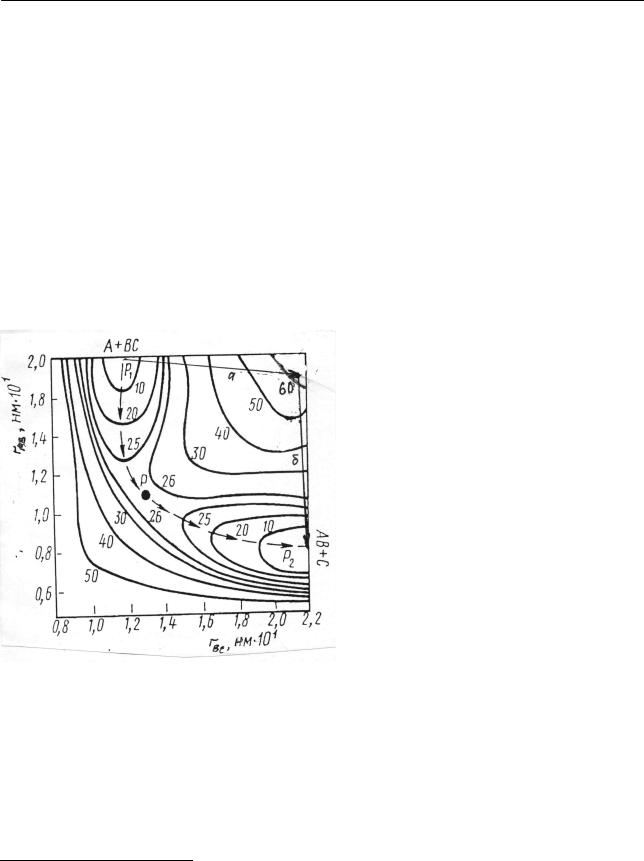
Пример получаемой таким образом карты ППЭ представлен на рис. 2.38.
Рис. 2.38. «Карта» поверхности потенциальной энергии при реакции
(2.310):
кривые – горизонтали (изоэнергетические линии); цифры у горизонталей – энергия в условных единицах; пунктирная линия – путь (координата) реакции
Очевидно, что густота расположения горизонталей свидетельствует о крутизне склона поверхности. На энергетической карте можно выделить «долину» P1, в
которой система A + BC находилась до реакции, и «долину» P2 , в которой на-
ходится система AB +C , возникшая в результате реакции. Переход системы от P1 к P2 связан с преодолением энергетического барьера, разделяющего эти до-
лины. Энергетически наиболее выгодным для такого перехода является путь, проходящий по «ложбине» через самую низкую точку Р «перевала». Точка Р и
1Для более сложных случаев требуется многомерная диаграмма.
2Орография (от греч. orós– гора и … графия) раздел геоморфологии, занимающийся описанием и классификацией форм рельефа по их внешним признакам вне зависимости от происхождения.
143

Х и м и ч е с к а я к и н е т и к а
соседние с ней участки отвечают области существования активированного комплекса, отличающегося от стабильных молекул своей неустойчивостью вдоль пути реакции. По отношению к изменениям в других направлениях активированный комплекс устойчив, так как эти изменения энергетически невыгодны. Энергетически невыгодны и любые другие пути протекания реакции (2.310). Например, можно представить себе первоначальную диссоциацию мо-
лекулы ВС на свободные атомы с последующей рекомбинацией А и В. это означало бы первоначальный подъем реагирующей системы на плоское плато с последующим спуском в долину продуктов P2 . Такой путь представлен на
рис. 2.38 стрелками а и б. Понятно, что так как плато находится значительно выше перевала Р, то необходимая затрата энергии ∆E была бы при этом значительно выше. Вероятность того или иного процесса (и скорость его осуществ-
ления) пропорциональна множителю e−∆E / RT , быстро убывающему с увеличением ∆E . Поэтому в подавляющем большинстве случаев реакция осуществляется по пути наименьшей затраты энергии.
Активированный комплекс отличается от обыкновенных молекул тем, что вдоль пути реакции он находится на вершине потенциального барьера и вместо одной колебательной степени свободы имеет дополнительную внутреннюю поступательную степень свободы вдоль пути реакции1. Таким образом можно резюмировать следующее. Активированный комплекс, содержащий n атомных ядер, может быть рассмотрен как обыкновенная молекула. Исходя из обычных термодинамических свойств [2] он должен иметь 3n степени свободы, из которых 3 степени свободы приходится на поступательное движение системы в целом, 3 (или 2 для линейного строения переходного состояния) – на вращательное движение и 3n − 6 (или 3n −5) – на колебательное движение. Однако в ак-
тивированном комплексе внутренняя энергия переходного состояния будет определяться одной степенью свободы поступательного движения вдоль координаты реакции и 3n − 7 (или 3n − 6 для линейного активированного комплекса)
степенями свободы колебательного движения. Данная особенность активированного комплекса обусловлена тем, что, совершив половину колебания, он скатывается на энергетической диаграмме с перевала Р в долину P2 , распадаясь
на продукты реакции. Все сформулированное выше относится уже к реагирующему комплексу и может не учитываться при его рассмотрении в качестве обычной молекулы.
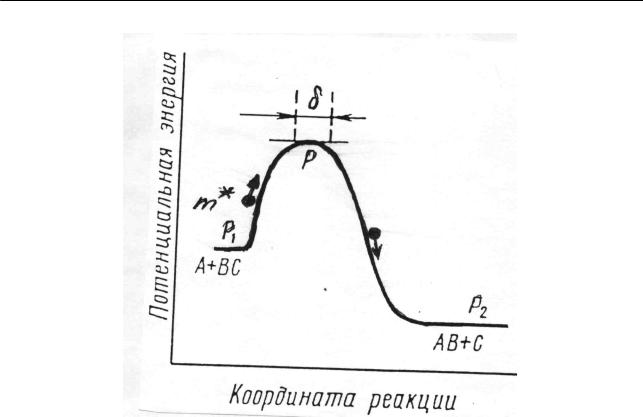
Если сделать разрез потенциальной поверхности, перпендикулярный к плоскости чертежа и проходящий вдоль пути реакции, а затем развернуть поверхность разреза в одну плоскость, то получим кривую, которую можно назвать энергетическим профилем пути реакции (рис. 2.39). При условии, что
1 Термины «путь реакции», «поступательное движение» и другие относятся к движению фигуративной точки активированного комплекса по ППЭ, но не к перемещению его самого в пространстве.
144
Х и м и ч е с к а я к и н е т и к а
Рис. 2.39. Энергетический профиль пути реакции (2.310)
энергия поступательного движения молекулы АВ и атома С будет достаточна велика, система сможет достигнуть перевала и спуститься к конечному состоянию. Если же кинетическая энергия поступательного движения молекулы АВ и атома С будет мала, то система при столкновении не достигает величины энергетического барьера и скатится к начальному состоянию. Высота максимума (рис. 2.39), или разность между энергией основного состояния активированного
комплекса E≠ |
и энергией исходных реагирующих веществ |
(E |
+ E |
|
) дает |
|||
0 |
|
|
|
|
0 AB |
0C |
|
|
истинную энергию активации реакции |
|
|
|
|
|
|
|
|
|
E = E≠ − (E |
+ E |
). |
|
|
(2.312) |
||
|
0 |
0 AB |
0C |
|
|
|
|
|
Рассмотренный материал и сведения, приведенные в 2.2.1.6, позволяют заключить, что построение ППЭ решает ряд важных задач и, в первую очередь, показывает принципиальный путь теоретического расчета энергии активации, который пока недоступен в связи с математическими сложностями. Во вторых, положение перевальной точки на ППЭ непосредственно дает межатомные расстояния в переходном состоянии. Кроме того, при условии точного построения ППЭ конфигурация перевальной седловины могла бы дать информацию о колебательных характеристиках переходного состояния.
Все эти данные необходимы для полного теоретического расчета скорости реакции. Построение ППЭ является первым этапом такого расчета.
145

Х и м и ч е с к а я к и н е т и к а
С учетом отмеченных математических трудностей в настоящее время пользуются приближенной математической моделью, так называемой теорией абсолютных скоростей реакций, предложенной в 1935 году Г. Эйрингом и М. Поляни. Эта математическая модель, используя некоторые упрощающие предположения о свойствах активированного комплекса, впервые позволила приближенно оценить предэкспоненциальный множитель. Энергию активации в этой теории не рассчитывают, а рассматривают как опытную величину.
В. Статистический аспект Для проведения статистического расчета скорости реакции в рамках рас-
сматриваемой теории прибегнем к механической аналогии, изображая взаимные превращения кинетической энергии в потенциальную и, наоборот, в трехатомной системе (2.310) аналогичными превращениям энергий тяжелой мате-
риальной частицы с некоторой эффективной массой m , скользящей без трения в гравитационном поле по ППЭ. Такой подход полностью оправдывает себя при надлежащем подборе эффективной массы. Следует подчеркнуть, что эффективная масса не является массой самого активированного комплекса. Это вспомогательная величина, не присутствующая в окончательных результатах и зависящая, например, от напряженности силы тяжести.
Вернемся к рассмотрению энергетического профиля пути реакции (2.310), приведенного на рис. 2.39, на котором такая частица (будем далее называть ее
частицей m ) изображена кружком. Если частица m обладает достаточной кинетической энергией, то сможет взобраться на перевальную точку Р и далее скатится со все возрастающей скоростью в сторону продуктов реакции. Другими словами, в этом случае в рассматриваемой трехатомной системе относительная кинетическая энергия при сближении частиц А и ВС достаточно велика для преодоления силы отталкивания и образования переходного состояния, которое затем распадается на продукты реакции.
В рамках проводимой аналогии понятно, что скорость протекания элементарного акта определяется скоростью пересечения вершины перевала частицей
m . Скорости пересечения, являющиеся по существу проявлением теплового движения молекул, будут самыми различными в разных актах, но при данной температуре скорость можно охарактеризовать какой-то средней величиной. Для упрощения расчета делается предположения о существовании на вершине перевала плоского участка пути реакции длиной δ (рис. 2.39), что равносильно допущению о существовании переходного состояния не в одной точке при строго фиксированных координатах – расстояниях rAB и rBC , но в некотором
интервале этих расстояний. Однако это не является принципиальным, так как величина δ произвольна, вводится лишь для наглядности расчета и выпадает из конечного результата. Принятие вершины перевала плоской позволяет движение фигуративной (изображающей) частицы на этом участке пути считать одномерным. Тогда среднюю скорость пересечения перевала можно рассчитать
146
Х и м и ч е с к а я к и н е т и к а
по формуле (2.265), как среднюю скорость теплового движения молекулы с массой m вдоль одной координаты
1/ 2
x = kT .2πm
Имеющиеся данные позволяют легко определить среднюю продолжительность жизни переходного состояния:
τl = |
δ |
=δ |
|
kT |
|
1/ 2 |
(2.313) |
|
|
|
|
|
|
. |
|||
|
|
|
|
|||||
|
x |
|
||||||
|
|
|
2πm |
|
|
|
||
Вполне естественно считать распад переходного состояния, т.е. реакцию
A…B …C → A + BC ,
мономолекулярной реакцией первого порядка. Как было показано при рассмотрении консекутивных реакций (см. 2.2.1.5.А), средняя продолжительность жизни вещества при его распаде является величиной обратной константе скорости реакции. Тогда последняя определяется соотношением
k(≠I ) |
|
1 |
|
kT |
|
|
|
1/ 2 |
1 |
|
(2.314) |
||||
= |
|
|
= |
|
|
|
|
|
|
|
|
, |
|||
τl |
|
|
|
|
δ |
||||||||||
|
|
2πm |
|
|
|
|
|
|
|||||||
а скорость реакции равна |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v = k(≠I )c≠ |
|
kT |
|
|
1/ 2 |
1 |
|
c≠ . |
(2.315) |
||||||
= |
|
|
|
|
|
|
|
||||||||
|
|
|
δ |
||||||||||||
|
|
|
|
2πm |
|
|
|
|
|
||||||
Входящая в выражение (2.315) концентрация активированных комплексов не
известна и должна быть заменена более легко определимыми величинами. Для этого используется допущение, введенное еще Аррениусом. Это допущение о равновесии между активными состояниями и исходными веществами
A + BC |
A…B …C , |
(2.316) |
|
позволяющее переписать (2.311), отражающее механизм реакции |
(2.310), в |
||
виде: |
|
|
|
A + BC A…B …C → AB +C . |
(2.317) |
||
Допущение (2.316) позволяет написать константу равновесия в виде |
|
||
Kc≠ = |
c≠ |
. |
(2.318) |
|
|||
|
cAcBC |
|
|
147

Х и м и ч е с к а я к и н е т и к а
Решая (2.318) относительно концентрации |
c≠ и подставляя ее в выражение |
||||||
(2.315), получаем |
|
|
|
|
|
|
|
kT |
|
1/ 2 |
1 |
|
≠ |
(2.319) |
|
v = |
|
|
|
|
Kc cAcBC . |
||
|
|
δ |
|||||
2πnm |
|
|
|
|
|
||
Для перехода от скорости реакции к константе скорости воспользуемся выражением основного закона для бимолекулярной реакции второго порядка (2.16):
v = k(II )cAcBC . |
(2.320) |
Сопоставляя (2.319) и (2.320), находим константу скорости рассматриваемой реакции:
1/ 2
k(II ) = kT δ1 Kc≠ . (2.321)2πm
Выражение (2.321) остается справедливым и для любой другой реакции. Все
различия будут заключаться в способе написания константы равновесия активированного комплекса.
Для определения Kc≠ воспользуемся методами статистической термодина-
мики, позволяющими выразить константу равновесия через суммы по состояниям на единицу объема
qi =Qi /V . |
(2.322) |
Запись константы равновесия через суммы по состояниям аналогична хорошо известной из термодинамики [2] записи ее через концентрации Kc , но с добав-
лением множителя e−∆U0 / RT , содержащего тепловой эффект реакции при абсолютном нуле ∆Uo = ∆E0 . Применительно к рассматриваемому случаю констан-
та будет иметь вид
|
(q≠ ) |
≠ |
|
(2.323) |
|
Kc≠ = |
|
e−E0 |
/ RT . |
||
qAqBC |
|||||
|
|
|
|
В выражении (2.323) теплота реакции при абсолютном нуле, которая
должна была бы стоять в показатели степени, заменяется энергией, затрачиваемой на образование активированного комплекса, – энергией активации при
абсолютном нуле E0≠ . В развернутом виде она записывается так:
E0≠ =U0≠ −U0 (A) −U0 (BC ),
где U0(i) – нулевые энергии участников процесса активации.
148

Х и м и ч е с к а я к и н е т и к а
Для исходных веществ обычно не составляет труда нахождение на основании молекулярных характеристик сумм по состояниям qA и qBC . Поэтому,
опуская выводы, приведем лишь основные соотношения, используемые при этом.
Полную молекулярную сумму по состояниям можно представить как произведение сумм, вычисленных для отдельных видов энергии, т.е.
Q =QпостQэлQколQвр |
(2.324) |
Поступательная сумма по состояниям для частицы массой m равна
Q |
= |
(2πmkT )3/ 2 |
V , |
(2.325) |
|
||||
пост |
h3 |
|
|
|
|
|
|
|
|
где V – объем.
Электронная сумма по состояниям при не очень высоких температурах равна вырожденности (мультиплетности) основного электронного уровня, т.е.
Qэл = g0 . |
(2.326) |
Колебательная сумма по состояниям в общем случае, когда число видов колебаний составляет 3n − x , записывается следующим образом:
3n−x |
(1 − e−hvi / kT )−1 , |
|
Qкол ≈ ∏ |
(2.327) |
i=1
где v – частота колебаний, с−1 ; hv / k=И – характеристическая температура [2]. Вращательная сумма по состояниям определяется в зависимости от типа
молекул следующим образом:
– для несимметричных двухатомных молекул
Q |
|
= 8π2kT I , |
(2.328) |
|||
вр |
|
|
h2 |
|
||
|
|
|
|
|
||
где I = µr2 –момент инерции, µ – приведенная масса, r |
– межъядерное рас- |
|||||
стояние; |
|
|
|
|
|
|
– для симметричных двухатомных молекул |
|
|||||
Q |
= |
1 |
8π2kT I ; |
(2.329) |
||
вр |
|
2 |
h2 |
|
||
– для линейных многоатомных молекул с осевой симметрией |
||||||
Q |
= |
|
1 |
8π2kT I |
(2.330) |
|
σ |
||||||
вр |
|
h2 |
|
|||
где σ – число симметрии, равное числу неразличимых состояний получающихся при вращении молекулы на 360о;
149

Х и м и ч е с к а я к и н е т и к а
– для тетраэдрических молекул
Q |
= |
π |
8π2kT 3/ 2 |
I 3/ 2 ; |
(2.331) |
||
|
|
|
|
||||
вр |
σ |
h2 |
|
|
|||
|
|
|
|
|
|
||
– для многоатомных несимметричных, нелинейных молекул
|
π |
8π2kT 3/ 2 |
1/ 2 |
|
|
|||
Qвр = |
|
|
h2 |
|
(IA IB IC ) |
, |
(2.332) |
|
σ |
||||||||
|
|
|
|
|
|
|||
где IA , IB , IC – моменты инерции молекулы относительно трех координатных осей.
Для определения суммы по состояниям активированного комплекса (q≠ ),
входящей в уравнение (2.323), ее прежде всего разбивают на два сомножителя, вынося из общей суммы член, соответствующий одномерному поступательному движению конфигуративной частицы m через вершину перевала. Используя уравнение (2.262), получим
(q≠ )= q≠ (2πm kT )1/ 2 |
δ , |
(2.333) |
h |
|
|
где q≠ – сумма по состояниям активированного комплекса для всех остальных видов энергии. Подставляя сумму по состояниям (q≠ ) из (2.333) в выражение (2.323) для константы равновесия, а затем полученный результат – в константу скорости (2.321)получим
|
kT |
|
|
1/ 2 1 |
|
(2πm kT )1/ 2 |
|
q≠ |
−E≠ / RT |
|||||||||
k(II ) = |
|
|
|
|
|
|
|
|
|
|
|
|
|
δ |
|
|
e |
0 |
2πm |
|
|
|
δ |
|
|
h |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
qAqBC |
|
|||||||
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
kT |
|
q≠ |
−E≠ / RT |
|
|
(2.334) |
|||||
|
k |
II |
) |
|
h |
|
|
e |
0 |
|
. |
|
||||||
|
|
|
|
|
|
|||||||||||||
|
|
( |
|
|
|
|
|
|
qAqBC |
|
|
|
|
|
||||
Уравнение (2.334), уже не содержащее вспомогательных величинm и δ , явля-
ется записью в общем виде константы скорости реакции (2.310).Для любой
другой реакции выражение для константы скорости имеет тот же вид. Различие будет состоять лишь в способе написания дроби с суммами по состояниям, представляющей константу равновесия. Уравнение (2.334) содержит универ-
150
