
Физ химия и физ т.д
..pdf
Х и м и ч е с к а я к и н е т и к а
Рис. 2.28. Зависимость логарифма константы скорости от обратной температуры для сложных реакций, не подчиняющихся уравнению Аррениуса
Для определения эффективной энергии активации ∑Ea можно использовать дифференциальную форму уравнения (2.239), а именно:
d ln k = − |
∑Ea |
1 |
|
|
∑Ea = −R |
d ln k |
|
(2.249) |
|
|
d |
|
|
, |
|
. |
|||
R |
|
d (1/T ) |
|||||||
|
T |
|
|
|
|
|
|||
Величину ∑Ea согласно уравнению |
(2.249) находят путем дифференци- |
||||||||
рования полученной экспериментальной зависимости ln k = f (1/T ). В связи с
тем, что эта зависимость, как видно из рис. 2.28, не является линейной1, наклон кривой уменьшается по мере увеличения 1/T (угол α2 меньше угла α1 ). По-
этому d ln k / d (1/T )<0 . В соответствии с (2.249) это означает увеличение эф-
фективной энергии активации с ростом величины 1/T , т.е. с уменьшением температуры.
2.2.1.7.Примеры и задачи
A. Примеры решения задач
Пример 1. В реакции второго порядка A + B → D начальные концентрации исходных веществ составляют: c0 A = 2,0 моль/ л, с0B =3,0 моль/ л. Скорость
реакции при текущей концентрации cA =1,5 моль/ л равна 1,2 10−3 моль/ (л с).
1 Она не может быть разделена и на два линейных участка, как в случае зависимости, представленной на рис. 2.27.
101

Х и м и ч е с к а я к и н е т и к а
Рассчитайте константу скорости и скорость реакции при текущей концентрации cB =1,5 моль/ л.
Решение
К моменту времени, когда cA =1,5 моль/ л, прореагировало1 2,0-1,5 =
= 0,5 моль/л вещества A. Это, с учетом того, что реакция между веществами A и B идет 1:1, означает, что к данному моменту времени прореагировало также и 0,5 моль/л вещества B
В соответствии с законом действующих масс, в любой момент времени скорость рассматриваемой реакции равна
v = kcAcB .
Следовательно, константу скорости реакции можно определить из выражения
k = |
v |
, |
|
cAcB |
|||
|
|
подставляя в которое конкретные значения величин получаем
k =1,2 10−3 = 3,2 10−4 л/ (моль с). 1,5 2,5
К моменту времени, когда cB =1,5 моль/ л, прореагировало по 1,5 моль/л веществ A и B, поэтому cA = 2,0 −1,5 = 0,5 моль/ л. Тогда, подставляя конкрет-
ные значения величин в вышеприведенное кинетическое уравнение, определяем величину скорости реакции в момент времени, отвечающий cB =1,5 моль/ л:
v = 3,2 10−4 0,5 1,5 = 2,4 10−4 моль/ (л с).
Пример 2. Установлено, что реакция второго порядка с одним исходным веществом завершается на 75% за 92 мин при начальной концентрации исходного вещества c0 = 0,24 моль/л. Какое время потребуется, чтобы при тех же ус-
ловиях концентрация реагента достигла 0,16 моль/л?
Решение
Запишем решение кинетического уравнения для данной реакции применительно к моменту времени τ1 =92 мин и к искомому моменту времени τ2 :
kτ1 |
= |
|
1 |
− |
1 |
, kτ2 = |
1 |
− |
1 |
. |
c0 |
− x1 |
|
c0 − x2 |
|
||||||
|
|
|
c0 |
|
c0 |
|||||
1 Здесь и далее под выражением «прореагировало вещества в моль/л» подразумевается понижение концентрации этого вещества в моль/л.
102

Х и м и ч е с к а я к и н е т и к а
Количество прореагировавшего вещества к моменту времени τ1 иτ2 , исходя из условия задачи, соответственно составит: x1 =0,75 0,24 = 0,18 моль/ л и
x2 = 0,24 − 0,16 = 0,08 моль/ л.
Поделим вышеприведенные кинетические уравнения одно на другое и из полученного отношения определим τ2 :
|
|
|
1 |
|
− |
1 |
|
|
|
|
c |
− x |
|
c |
|||
|
|
|
|
|||||
τ2 =τ1 |
|
0 |
2 |
|
|
0 |
. |
|
|
|
1 |
|
|
|
|||
|
|
|
|
− |
1 |
|
|
|
|
|
c |
− x |
c |
||||
|
|
|
|
|||||
|
|
0 |
1 |
|
|
0 |
|
|
Подставляя в это выражение конкретные значения величин, определим время, необходимое для достижения концентрации исходного вещества 0,16 моль/л:
|
|
1 |
− |
1 |
|
|
τ2 |
= 92 |
0,16 |
0,24 |
=15,3 мин. |
||
|
||||||
|
|
1 |
− |
1 |
|
|
|
|
0,06 |
0,24 |
|
||
|
|
|
|
Пример 3. Вещество A смешали с веществами B и C в равных концентрациях, составляющих 1 моль/л. Через 1000 с осталось 50% вещества A. Сколько вещества A останется через 2000 с, если реакция имеет: а) нулевой, б) первый, в) второй, г) третий общий порядок?
Решение
Указание в условии задачи на то, что через 1000 с осталось 50% вещества A означает, что время полупревращения реакции τ1/ 2 =1000 c .
а) Для реакции нулевого порядка концентрация вещества в данный момент времени отвечает выражению
c =c0 − kτ .
Константу скорости можем определить по формуле
k =c0 / 2τ1/ 2 ,
подставляя в которую конкретные значения величин, получаем: k =1/ 2 1000 = 0,0005 моль/ (л с).
Тогда искомое значение с через 2000 с составит:
с =1 − 0,0005 2000 = 0 моль/ л,
что идентично 0%, т.е. реакция пройдет нацело.
103

Х и м и ч е с к а я к и н е т и к а
б) Для реакции первого порядка убыль вещества x за время τ отвечает выражению
x =c0 (1 −e−kτ ).
Константу скорости можем определить по формуле k =0,693/τ1/ 2 ,
подставляя в которую конкретные значения величин, получаем: k =0,693/1000 =0,000693 c−1.
Тогда убыль вещества через 2000 с составит:
x =1(1 −e−0,000693 2000 )=0,75 моль/ л,
а оставшаяся концентрация вещества с = 1-0,75 = 0,25 моль/л, что равносильно 25% начальной концентрации.
в) Для реакции второго порядка убыль вещества x за время τ отвечает выражению
x =c0 1 − kτc1 +1 .
0
Константу скорости можем определить по формуле
k =1/τ1/ 2c0 ,
подставляя в которую конкретные значения величин, получаем: k =1/1000 1 =0,001 л/ (моль с).
Тогда убыль вещества через 2000 с составит:
|
|
1 |
|
|
|
|
|
x =1 1 |
− |
|
|
|
=0,667 |
моль/ л, |
|
0,001 2000 1 +1 |
|||||||
|
|
|
|
|
|||
а оставшаяся концентрация вещества с = 1-0,667 = 0,333 моль/л, что равносильно 33,3% начальной концентрации.
г) Для реакции третьего порядка убыль вещества x за время τ отвечает выражению
|
|
|
1 |
|
x =c |
1 − |
|
. |
|
|
|
|||
0 |
|
1 |
+ 2kc2τ |
|
|
|
|
0 |
|
Константу скорости можем определить по формуле
104

Х и м и ч е с к а я к и н е т и к а
k = |
|
3 |
|
, |
|
2τ |
1/ 2 |
c2 |
|||
|
|
||||
|
|
0 |
|
подставляя в которую конкретные значения величин, получаем:
k = |
|
3 |
=0,0015 л2 / (моль2 с). |
|
1000 12 |
||
2 |
|
||
Тогда убыль вещества через 2000 с составит:
|
|
1 |
|
|
|
|
x =1 1 |
− |
|
|
=0,622 |
моль/ л, |
|
2 |
|
|||||
|
|
2000 |
|
|
|
|
|
|
1 + 2 0,0015 1 |
|
|
|
а оставшаяся концентрация вещества с = 1-0,622 = 0,378 моль/л, что равносильно 37,8% начальной концентрации.
Пример 4. В некоторой реакции A → B целого порядка n концентрация исходного вещества 0,5 моль/л была достигнута за 4 мин при начальной концентрации 1 моль/л и за 5 мин при начальной концентрации 2 моль/л. Установите порядок реакции.
Решение
Из первого опыта следует, что время полупревращения вещества при начальной концентрации 1 моль/л равно 4 мин.
Изменение концентрации от 2 моль/л до 0,5 моль/л во втором опыте, с учетом результатов первого опыта, можно разбить на два периода. Изменение концентрации от 1 моль/л до 0,5 моль/л произошло за 4 мин (первый опыт), а следовательно на превращение от 2 моль/л до 1 моль/л потребовалось 5 − 4 = 1 мин. Последнее позволяет заключить, что время полупревращения во втором опыте составило 1 мин.
Таким образом, при увеличении начальной концентрации в 2 раза время полупревращения уменьшилось в 4 раза.
Обобщенное выражение для зависимости времени полупревращения от начальной концентрации для реакций с любым n имеет следующий вид:
τ |
1/ 2 |
= const . |
|
cn−1 |
|
|
|
0 |
Это уравнение, с учетом полученных выше результатов, для рассматриваемой реакции можно представить в виде
τ1/ 2 |
= |
const |
. |
|
4 |
|
(2c |
)n−1 |
|
|
|
0 |
|
|
Из последнего выражения явствует, что 4 = 2n−1 , а следовательно порядок реакции n = 3.
105

Х и м и ч е с к а я к и н е т и к а
Пример 5. Реакция омыления метилацетата при 298 K описывается уравнением:
CH3COOCH3 + NaOH →CH3COONa + CH3OH .
Для этой реакции получены следующие кинетические данные:
Время, мин |
3 |
5 |
7 |
10 |
15 |
25 |
сNaOH , ммоль/л |
7,40 |
6,34 |
5,50 |
4,64 |
3,63 |
2,54 |
Исходные концентрации щелочи и эфира одинаковы и равны 0,01 моль/л. Определите методами подстановки и графическим порядок реакции (первый или второй). Рассчитайте среднюю константу скорости.
Решение
При решении указанными в условии методами будем учитывать следующее:
– для реакции первого порядка справедлива формула k(I ) = τ1 ln cc0 = τ1 (ln c0 − ln c);
– для реакции второго порядка справедлива формула
k(II ) = |
1 |
|
1 |
1 |
|
; |
|
τ |
c |
− |
|
|
|||
c |
|||||||
|
|
|
|
0 |
|
|
|
–критерием определения порядка реакции является постоянство величины
k при использовании соответствующей формулу для различных значений c = f (τ );
– |
для реакций первого порядка зависимость ln c = f (τ ) |
линейна; |
– |
для реакций второго порядка зависимость 1/ c = f (τ ) |
линейна. |
Решение методом подстановки проведем в табличной форме, первоначально переведя исходные данные: время в с а концентрацию в моль/л. Приводящиеся в таблице данные при τ =0 c являются, соответственно значениями
c0 , ln c0 и 1/ c0 .
106
Х и м и ч е с к а я к и н е т и к а
|
|
|
|
|
|
|
|
|
τ, c |
0 |
180 |
|
300 |
420 |
600 |
900 |
1500 |
c, моль/ л |
0,01 |
0,00740 |
|
0,00634 |
0,00550 |
0,00464 |
0,00363 |
0,00254 |
ln c |
-4,605 |
-4,906 |
|
-5,061 |
-5,203 |
-5,373 |
-5,619 |
-5,976 |
k(I ), c−1 |
– |
0,00167 |
|
0,00152 |
0,00142 |
0,00537 |
0,00113 |
0,00091 |
|
|
|
|
|
|
|
|
|
k(I ) уменьшается |
во |
времени, |
т.е. k(I ) ≠ const . Следовательно, рассматри- |
|||||
ваемая реакция не является реакцией первого порядка.
|
|
|
|
|
|
|
|
1/ c, л/ моль |
100,00 |
135,14 |
157,73 |
181,82 |
215,52 |
275,48 |
393,70 |
|
|
|
|
|
|
|
|
k(II ), л/ (моль с) |
– |
0,195 |
0,192 |
0,195 |
0,193 |
0,195 |
0,196 |
k(II ) ≈const . Следовательно, рассматриваемая реакция является реакцией
второго порядка.
Средний коэффициент скорости реакции k(II ) =0,194 л/ (моль с).
На рис. 2.29 приведены зависимости ln c = f (τ ) и 1/ c = f (τ ).Как видно из
Рис. 2.29. Определение порядка реакции графическим методом рисунка, зависимость 1/ c = f (τ ) линейная, что указывает на второй порядок
рассматриваемой реакции. Результаты, полученные графическим методом, полностью подтверждают результаты, полученные методом подстановки.
107

Х и м и ч е с к а я к и н е т и к а
Пример 6. Реакция первого порядка при температуре 70 oC завершается на
40% за 60 мин. При какой температуре реакция завершится на 80% за 120 мин, если энергия активации равна 60 кДж/моль?
Решение
Для реакции первого порядка константа скорости может быть выражена через степень превращения β = x / c0 (x – убыль концентрации вещества за время
τ , c0 – начальная концентрация вещества) следующим образом:
k = |
1 ln |
|
c0 |
= − |
1 ln |
c0 − x |
= − |
1 ln (1 |
− β ). |
|
c |
− x |
c |
||||||||
|
τ |
|
τ |
|
τ |
|
||||
|
|
0 |
|
|
|
0 |
|
|
|
Запишем это уравнение с учетом уравнения Аррениуса для двух температур
Ae−Ea / RT = − |
1 |
|
ln (1 − β |
); Ae−Ea / RT = − |
|
1 |
ln (1 − β |
2 |
), |
|||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||
|
τ1 |
|
|
1 |
|
|
|
|
|
|
|
|
|
|
τ2 |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
где Ea = 60 кДж/ моль, Т1 = 70 + 273 =343 K , |
τ1 =3600 c , β1 = 0,4 , τ2 = 7200 c , |
|||||||||||||||||||||||||||||
β2 = 0,8 . Поделим одно уравнение на другое и прологарифмируем |
||||||||||||||||||||||||||||||
|
E 1 |
|
1 |
|
τ2 ln (1 − β1 ) |
|
|
|||||||||||||||||||||||
|
a |
|
|
= ln |
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|||||||||||
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
R |
T |
T |
τ |
1 |
ln (1 |
− β |
2 |
) |
|
|
|
||||||||||||||||||
|
|
|
2 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Из этого уравнения определим выражение для T2 |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
T2 = |
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
, |
|
|
|
||||||
|
|
|
|
τ |
2 ln (1 − β1 ) |
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
R |
ln |
1 |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
E |
τ |
1 |
ln (1 − |
β |
2 |
) |
T |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
a |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|||||
подставляя в которое приведенные выше значения конкретных величин и вы-
ражая R в кДж/моль ( R = 8,314 10−3 кДж/моль) находим
T |
= |
|
|
|
|
1 |
|
|
|
|
|
= 333 K = 60 oC . |
|
|
|
|
7200ln (1 |
− 0,4) |
|
|
|
|
|||
2 |
|
|
8,314 10 |
−3 |
|
|
|
1 |
|
|
||
|
|
|
|
ln |
|
+ |
|
|
||||
|
|
|
60 |
|
3600ln (1 |
− 0,8) |
343 |
|
|
|||
|
|
|
|
|
|
|
|
|
Пример 7. Разложение ацетондикарбоновой кислоты в водном растворе – реакция первого порядка. Измерены константы скорости k1, k2 , k3 , k4 этой реак-
ции соответственно при нижеприведенных возрастающих температурах
T1,T2 , T3 T4 :
108

Х и м и ч е с к а я к и н е т и к а
|
|
|
|
|
T , K |
273 |
293 |
313 |
333 |
k 105 , c−1 |
2б46 |
47б5 |
576 |
5480 |
На основании экспериментальных данных необходимо:
а) рассчитать: энергию активации и предэкспоненциальный множитель;
б) определить константу скорости реакции k5 и время полупревращения τ1/ 2 при температуре T5 = 298 K , а также температуру T6 , при которой констан-
та скорости k6 =1905 10−5 c−1 ; |
вещества x, |
|
в) вычислить количество |
которое прореагировало при |
|
T = 298 K к моменту времени |
τ = 4,80 103 c , |
если начальная концентрация |
5 |
|
|
ацетондикарбоновой кислоты c0 =1,75 моль/ л;
г) определить температурный коэффициент скорости реакции; д) найти энергию активации графическим методом по зависимости
lg k = f (1/T );
е) по графику зависимости lg k = f (1/T ) определить константу скорости реакции k5 и температуру T6 ;
ж) рассчитать погрешности определения величин Ea , k5 иT6 аналитическим методом по сравнению с графическим.
Решение
Представим условие задачи и величины (константы скорости и температуры), необходимые для определения1 по пункту б), в табличной форме. В нее же
включим значения величин |
1 |
103 |
иlg k , которые, как известно из теоретическо- |
||||||||
|
|||||||||||
|
|
|
|
|
T |
|
|
|
|
|
|
го материала (см. 2.2.1.6), будут необходимы для последующих расчетов. |
|||||||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
T1 |
T2 |
|
T3 |
T4 |
T5 |
T6 |
||
|
|
T , K |
273 |
293 |
|
|
313 |
333 |
298 |
? |
|
|
|
|
k1 |
k2 |
|
k3 |
k4 |
k5 |
k6 |
||
|
|
k, c−1 |
2,46 10−5 |
47,5 10−5 |
|
576 10−5 |
5480 10−5 |
? |
1905 10−5 |
||
|
|
|
|
|
|
|
|
||||
|
1 |
103 , K −1 |
3,663 |
3,413 |
|
3,195 |
3,003 |
3,356 |
|
||
T |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
lg k |
-4,609 |
-3,323 |
|
-2,240 |
-1,261 |
|
-1,720 |
||
1 Величины, которые требуется определить, отмечены знаком ?. 109
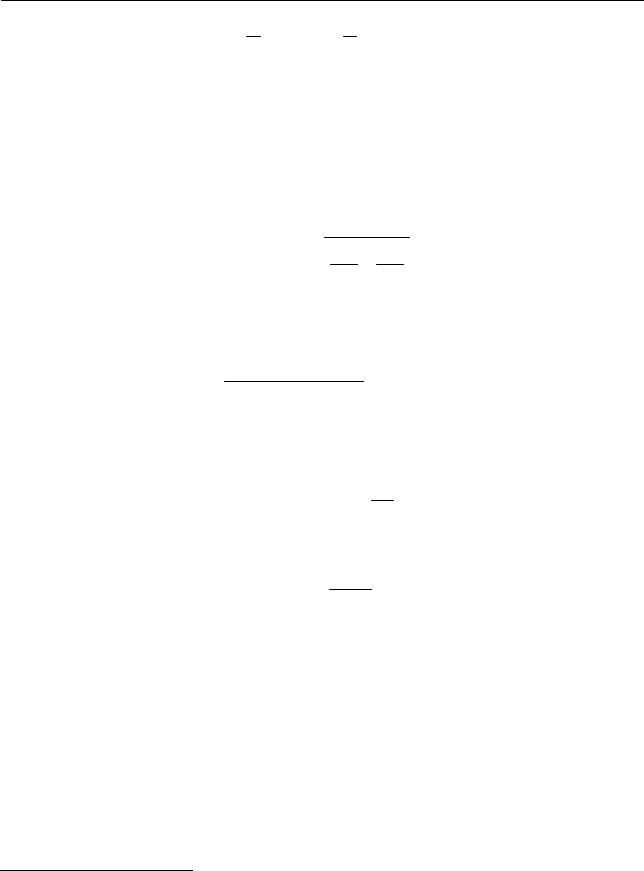
Х и м и ч е с к а я к и н е т и к а
Использование величины T1 103 , а не T1 обусловлено необходимостью пе-
ревода значения R в кДж/(К моль), позволяющего получать значения Ea непо-
средственно в кДж/моль [см. расчет по пункту а)]. Десятичные логарифмы при решении применяем в связи с указанием в пунктах д) и е) на использование зависимости lg k = f (1/ T ).
а) Расчет энергии активации и предэкспоненциального множителя. Для расчета энергии активации уравнение (2.242)запишем в виде1
Ea = 2,303R lg k4 − lg k1 , 103 −103
T1 T4
учитывающем, перевод R в кДж/(К моль) (коэффициент 103 ). Подставляя в это уравнение конкретные значения величин2, имеем:
Ea =19,148 −1,261 − (−4,609) = 97,1 кДж/ моль. 3,663 − 3,003
Для расчета предэкспоненциального множителя уравнение (2.244) запишем в виде
lg A = lg k1 + 0,4343 Ea 103
R T1
Подставляя в это уравнение конкретные значения величин, имеем: lg A = −4,609 + 0,4343897,1.314 3,663 =13,971,
а, следовательно, предэкспоненциальный множитель A =9,35 1013 c−1 .
б) Определение константы скорости реакции k5 и времени полупревращения τ1/ 2 при температуре T5 = 298 K , а также температуры T6 , при которой константа скорости k6 =1905 10−5 c−1 .
В решении по пункту а) нами было записано выражение для энергии активации в интервале температур (T1 −T4 ). Записав аналогичное выражение для
интервала температур (T1 −T5 ), приравняв, с учетом независимости энергии активации от температуры, эти выражения и сократив их на 2,303R получим:
1Для достижения при расчете наибольшей точности выбирается максимальный интервал температур – (T1 − T4 ).
2При расчетах, в соответствии с [16], берем 2,303R = 19,148 Дж/(К моль).
110
