
Физ химия и физ т.д
..pdf
Х и м и ч е с к а я к и н е т и к а
Как следует из выражений (2.399), (2.400), (2.402), во всех случаях ско-
рость гомогенной каталитической реакции прямо пропорциональна концентрации реагирующих веществ и катализатора.
Отношение констант скорости данной реакции для однотипных, но различных катализаторов на основе формул (2.374)и (2.382) можно представить в
виде
|
|
|
∆S0≠−∆S0≠ |
|
Eа′′ |
|
−Еа′ |
|
|||
|
|
1 |
2 |
|
к |
|
к |
(2.403) |
|||
k / k |
2 |
= e |
|
R |
e |
|
RT |
|
, |
||
1 |
|
|
|
|
|
|
|
|
|
|
|
где k1, k2 – константы скорости одной и той же реакции, но с различными катализаторами; ∆S10≠ , ∆S20≠ и Eа′к , Еа′′к – соответственно энтропии и энергии актива-
ции этих двух реакций.
Если для каталитических реакций, идущих по одному и тому же механизму на различных катализаторах, энтропия активации примерно одинакова
(∆S10≠ ≈ ∆S20≠ ), то уравнение (2.403) упрощается:
Eа′′к −Еа′к
k / k |
2 |
= e |
RT |
. |
(2.404) |
1 |
|
|
|
|
При помощи соотношений (2.403) и (2.404) можно сравнить константы
скорости, скорости реакций и соответственно каталитические активности различных катализаторов.
Отсутствие единой современной теории катализа не позволяет учесть все многообразные причины, вызывающие каталитические реакции.
Гетерогенный катализ отличается спецификой, обусловленной существенным влиянием на каталитическую активность катализатора величины и свойств поверхности, ее структуры, химического состава поверхностного слоя и т.п. Различные теории гетерогенного катализа основаны на предположении, что каталитические реакции происходят через образование поверхностных промежуточных соединений. Каталитическую реакцию можно рассматривать как совокупность чередующихся стадий образования этих соединений и их последующего разрушения с выделением продуктов реакции. При этом в процессе образования промежуточных соединений атомы и ионы поверхности сохраняют свои связи с атомами и ионами в объеме, что обусловливает большую реакционную способность поверхностных соединений.
2.3.4. Адсорбция на поверхности катализатора
Поверхность твердых тел обладает избыточной энергией Гиббса. Тенденция к ее уменьшению в системах, где твердая фаза находится в контакте с газом или жидким раствором, проявляется главным образом в способности удерживать на поверхности молекулы газа или растворенного вещества. Последнее возможно
181

Х и м и ч е с к а я к и н е т и к а
в тех случаях, когда молекулы растворенного вещества взаимодействуют с поверхностью сильнее, чем с молекулами растворителя. Явление, заключаю-
щееся в образовании поверхностного слоя с повышенной концентрацией газа или растворенного вещества на границе раздела с твердым телом, получило название адсорбции. Другими словами адсорбцию можно определить как поглощение вещества на поверхности раздела фаз. Вещество (твердое тело) на поверхности которого происходит адсорбция, называют адсорбентом, а вещество, поглощаемое из объемной фазы, т.е. концентрирующееся на поверхности адсорбента – адсорбатом.
Адсорбция может осуществляться в результате взаимодействий различной природы. Так, в частности, между частицами адсорбата и поверхностью адсорбента всегда действуют ван-дер-ваальсовы силы (дисперсионные, индукционные и ориентационные). Они приводят к тому, что, если температура не слишком высока, все газы адсорбируются на поверхности твердых тел. Адсорбция, происходящая за счет ван-дер-ваальсовых взаимодействий, называется физической адсорбцией. Физическая адсорбция – обратимый процесс.
При повышенных давлениях, приближающихся к давлению насыщенных паров адсорбата, поверхность не только покрывается полностью слоем физически адсорбированных частиц, но и на первом слое происходит дальнейшая адсорбция с образованием последующих слоев. Адсорбция с образованием нескольких молекулярных слоев адсорбата на поверхности адсорбента называется полимолекулярной. Как правило, с поверхностью вещества более прочно связаны частицы первого слоя. Образование последующих слоев напоминает конденсацию адсорбируемого вещества. Поэтому при полимолекулярной адсорбции свойства адсорбированного вещества в некоторых отношениях подобны свойствам жидкости. Так, в адсорбционных слоях могут растворяться другие вещества, присутствующие в газовой фазе наряду с адсорбатом.
В процессе физической адсорбции адсорбат переходит в более упорядоченное состояние, т.е. наблюдается уменьшение энтропии (∆S <0). Поэтому ад-
сорбция, как самопроизвольный процесс (∆G <0), всегда связана с уменьшением энтальпии (∆H = ∆G +T ∆S <0), т.е. является экзотермическим процессом. В соответствии с уравнением изобары Вант-Гоффа [2]
d ln K |
= |
∆H 0 |
|||
|
dT |
|
RT |
2 , |
|
|
p |
|
|
||
адсорбция убывает с ростом температуры.
Физическая адсорбция по ряду основных признаков имеет определенное сходство с конденсацией газов (паров): обратимость и сравнительно большая скорость достижения равновесия, близкие энтальпии процессов. Это обусловлено общностью природы межмолекулярных взаимодействий, приводящих к конденсации и к физической адсорбции, – главную роль в обоих случаях играют нековалентные по своей природе сила Ван-дер-Ваальса и в некоторых слу-
182

Х и м и ч е с к а я к и н е т и к а
чаях – водородные связи. Именно природа этих сил определяет еще одну важную особенность физической адсорбции – неспецифичность. На поверхности различных веществ один и тот же газ адсорбируется практически одинаково, при этом практически никак не влияя на структуру поверхностного слоя твердого адсорбента. Сами молекулы адсорбата сохраняют свою индивидуальность и десорбируются (десорбция – явление обратное адсорбции) неизменными.
Адсорбция, обусловленная проявлением химических, валентных сил под действием которых между молекулами адсорбата и поверхностью тела образу-
ются химические связи, называется активированной адсорбцией, химической адсорбцией или хемосорбцией. Способностью к хемосорбции обладают молекулы с высоким запасом энергии. Хемосорбированные молекулы на поверхности твердого тела представляют собой поверхностные химические соединения, которые по своим свойствам сильно отличаются от аналогичных объемных химических соединений.
Процесс хемосорбции сходен с химической реакцией и поэтому характеризуется высокой специфичностью (избирательностью), т.е. для определенного адсорбата количество хемосорбированного вещества очень чувствительно к химической природе адсорбента (хемосорбента). Так, оксид углерода СО удерживается на поверхности меди и платины сравнительно слабо, а в случае никеля и палладия образуются более прочные поверхностные соединения типа
Me
C =O ,
Me
где Ме – атом металла. Как и для химических реакций, теплоты химической адсорбции могут быть весьма значительными – намного больше теплот конденсации. Так, при хемосорбции тепловые эффекты достигают 400 кДж/ моль и бо-
лее. Еще одним принципиальным отличием хемосорбции от физической адсорбции является то, что хемосорбция – необратимый процесс. В результате образования при хемосорбции более прочных связей хемосорбированное вещество с трудом удаляется с поверхности адсорбента, причем десорбция может сопровождаться химическими превращениями. Например, связь, образуемая при адсорбции кислорода на поверхности угля настолько прочная, что при десорбции в газовую фазу выделяются оксиды углерода CO и CO2 . Во многих
случаях, как, например, при адсорбции CO2 на Al2O3 , на поверхности адсорбен-
та могут одновременно находиться физически и химически адсорбированные молекулы.
Хемосорбция играет важную роль при протекании гетерогенных реакций, имеющих, как правило, сложный (многостадийный) механизм, обязательно включающий хемосорбционные процессы. Например, образование CaCO3 на-
чинается с хемосорбции CO2 на CaO ; для синтеза аммиака необходима хемо-
сорбция азота и водорода на поверхности катализатора, с которой после химических превращений десорбирует аммиак.
183

Х и м и ч е с к а я к и н е т и к а
У сплошных не слишком малых частиц твердого тела, как кристаллических, так и аморфных, доля поверхностного слоя невелика. Однако она может быть увеличена на несколько порядков, если твердое тело имеет пористую структуру (например, активированный уголь, силикагель). У таких материалов поверхность может достигать сотен квадратных метров на грамм адсорбента, что делает возможным адсорбцию значительного количества газа или растворенного вещества.
Количественной характеристикой адсорбции является количество вещества адсорбата, приходящееся на единицу поверхности или единицу массы адсорбента. Эта величина, обозначаемая символом Г, является функцией внешних условий (в первую очередь температуры) и зависит от концентрации адсорбата с. Зависимость Г(с) при заданной температуре называется изотермой адсорб-
ции.
Простейшим уравнением для изотермы адсорбции является уравнение Ленгмюра, которое выводится в предположении наличия на поверхности определенного числа центров, каждый из которых независимо от остальных центров способен связать одну частицу адсорбата. Процесс рассматривается как полностью обратимый, представляющий собой своего рода реакцию между молекулами адсорбата и центрами адсорбции, уравновешенную обратным процессом – освобождения молекул адсорбата – десорбцией. Такой процесс можно охарактеризовать константой равновесия K, определяемой как константа диссоциации комплекса адсорбент – адсорбат:
K = |
Ac |
, |
(2.405) |
|
Г |
|
|
где A – поверхностная концентрация незанятых центров.
Суммарное число свободных и занятых центров – величина постоянная, равная величине предельно возможной адсорбции Г∞ , т.е.
A + Г = Г∞. |
(2.406) |
Из (2.405) и (2.406) легко получить выражение для зависимости Г от с
Г = |
|
|
Г∞ |
. |
(2.407) |
|
1 |
+ K / c |
|||||
|
|
|
||||
Константа K в уравнении (2.407) имеет размерность концентрации, т.е. K ≡ Kc .
В случае адсорбции газа вместо концентрации можно ввести пропорциональное ей давление газа и преобразовать (2.407) к виду
Г = |
Г∞ |
(2.408) |
1 + K / p . |
184

Х и м и ч е с к а я к и н е т и к а
Константа K в уравнении (2.408) имеет размерность давления, т.е. K ≡ K p . За-
висимость адсорбции от концентрации носит гиперболический характер (рис. 2.43). По мере увеличения концентрации адсорбата адсорбция, согласно уравнению Ленгмюра, стремится к постоянному предельному значению Г∞ .
Как видно из (2.407) и (2.408) константа K числено равна той концентрации
(давлению) адсорбата, при которой адсорбция достигает половины от предельного значения. Если K c (K p), то адсорбция близка к предельной и прак-
тически не зависит от концентрации (давления). Если K c (K |
p), то зави- |
симость принимает соответственно вид |
|
Г =(Г∞ / K )c |
(2.409) |
или |
|
Г =(Г∞ / K )p , |
(2.410) |
т.е. адсорбция становится линейной функцией концентрации (давления).
Рис. 2.43. Изотерма адсорбции Ленгмюра
Допущение о независимости адсорбции в каждом отдельном центре на поверхности, как и допущение, что на каждом центре адсорбируется всего одна молекула, являются приближенными. Поэтому уравнение Ленгмюра следует рассматривать как приближенное. В более строгих подходах следует учитывать взаимодействие между адсорбированными частицами, а также неоднородность поверхности, т.е. различие адсорбционных центров по теплоте адсорбции.
2.3.5. Лимитирующие стадии гетерогенно-каталитического процесса
Адсорбция реагирующих веществ на поверхности катализатора является одним из факторов, обусловливающих бóльшую сложность процессов, протекающих при гетерогенном катализе, по сравнению с имеющими место при гомогенном. Разнообразность процессов, происходящих в гетерогенном катализе, делает затруднительной возможность дать общую схему математического опи-
185

Х и м и ч е с к а я к и н е т и к а
сания процесса. Гетерогенно-каталитический процесс протекает через ряд стадий: диффузия исходных веществ из потока к внешней поверхности катализатора; диффузия исходных веществ в порах зерна катализатора; адсорбция исходных веществ на поверхности катализатора; собственно химическая реакция; десорбция продуктов с поверхности катализатора; диффузия продуктов с внутренней поверхности зерна катализатора (к поверхности пор); диффузия продуктов с внешней поверхности зерна.
В связи с этим различают пять основных кинетических областей работы катализатора в гетерогенно-каталитическом процессе: 1. внешнекинетическая область, в которой скорость процесса лимитируется самой химической реакцией; 2. адсорбционная область, в которой скорость процесса определяется адсорбцией исходного вещества или десорбцией продукта реакции; 3. внешнедиффузионная область, в которой скорость процесса лимитируется скоростью диффузии исходных веществ из потока к внешней поверхности катализатора или скоростью диффузии продуктов реакции от нее в поток; 4. внутридиффузионная область, в которой скорость процесса контролируется диффузией исходных веществ от внешней поверхности зерна к его внутренней поверхности, или диффузией продуктов реакции в обратном направлении. Скорость диффузии в данном случае зависит от кинетических параметров реакции; 5. внутрикинетическсая область, в которой скорость процесса определяется скоростью химической реакции, протекающей на поверхности пор зерна, т.е. на его внутренней поверхности. Следует отметить отсутствие строгих границ между этими областями работы катализатора. Они перекрываются промежуточными (переходными) областями, в которых сочетаются закономерности разных областей.
Исходя из того, что любая из перечисленных выше стадий, через которые протекает гетрогенно-каталитический процесс, может контролировать его, становится справедливо заключение о том, что кинетические закономерности
гетерогенно-каталитического процесса могут контролироваться как законами собственно химической кинетики, так и закономерностями массопереноса и законами адсорбции.
По ходу всего предыдущего рассмотрения весьма подробно были освещены основные законы химической кинетики, а в 2.3.4. – основополагающие моменты, связанные с адсорбцией на поверхности катализатора. В то же время, вне нашего рассмотрения остались закономерности массопереноса, знание которых необходимо при рассмотрении гетерогенных реакций, одним из примеров которых являются гетерогенно-каталитические процессы.
Гетерогенный процесс, лимитируемый стадией массопереноса, может осуществляться за счет конвекции и диффузии.
Конвекцией называется перемещение всей среды в целом. На границе раствора с твердой поверхностью конвекция может происходить из-за разной плотности раствора в объеме раствора и вблизи поверхности твердого тела, что обусловлено неодинаковой концентрацией или температурой в растворе. Такая конвекция получила название самопроизвольной. Более эффективной является
186

Х и м и ч е с к а я к и н е т и к а
конвекция, создаваемая перемещением твердого тела в растворе или раствора вблизи поверхности твердого тела (вращение твердого тела, перемешивание раствора). Такая конвекция получила название принудительной.
Диффузией называется перемещение молекул вещества в неподвижной среде под влиянием градиента концентрации. Различают диффузию линейную
и пространственную; бесконечную и ограниченную; стационарную и неста-
ционарную. Линейная диффузия происходит в одном направлении, пространственная – в разных направлениях. Если фронт диффузии в процессе гетерогенной реакции не успевает достигнуть границы системы, то диффузия называется бесконечной. Диффузия является ограниченной, если фронт диффузии достигает границы системы. Под фронтом диффузии понимается граница внутри раствора, где еще не заметны (с заданной погрешностью) изменения в концентрации, вызванные процессом диффузии. При стационарной диффузии концентрация вещества в любой точке пространства не меняется со временем; при нестационарной – меняется. На практике во многих случаях, например, при внешней массопередаче, процесс определяется, с одной стороны, молекулярной диффузией, а с другой – непосредственной передачей вещества благодаря наличию скорости потока. Такой процесс суммарного подвода вещества называется конвективной диффузией. Уже приведенная краткая классификация процессов диффузии говорит о том, что данное явление – предмет самостоятельного рассмотрения, выходящего за рамки настоящего изложения. В учебной литературе, те или иные вопросы, связанные с диффузионными процессами, в том числе протекающими в различного типа реакторах при гетерогенном катализе, нашли отражение, например, в [4–6, 10, 11]. Мы же ограничимся лишь рассмотрением фундаментальных зависимостей, лежащих в основе всех диффузионных процессов, и некоторых вопросов макрокинетики гетерогенно-каталитических процессов.
Скорость диффузии газа или растворенного вещества измеряется количеством молей n диффундирующего вещества через данное поперечное сечение в единицу времени τ. Количественные закономерности диффузии описываются двумя законами (уравнениями) Фика. Согласно первому закону Фика скорость диффузии dn / dτ пропорциональна площади S поперечного сечения и градиенту концентрации dc / dx :
dn |
= −DS dc |
, |
(2.411) |
dτ |
dx |
|
|
где D – коэффициент пропорциональности, называемый |
коэффициентом |
||
диффузии, м2 / с. Знак минус указывает, что концентрация в направлении диффузии убывает. Из (2.411) коэффициент диффузии определяется выраже-
нием
dn / dτ |
(2.412) |
D = − S (dc / dx). |
187

Х и м и ч е с к а я к и н е т и к а
Если принять S =1 м2 и dc / dx =1 моль/ м4 , то согласно (2.412) коэффициент диффузии равен скорости диффузии через сечение, равное 1 м2 при градиенте концентрации равном 1 моль/ м4 .
С увеличением температуры коэффициент диффузии вещества в растворе растет, так как вязкость растворителя уменьшается. Зависимость коэффициента диффузии от температуры можно получить следующим образом. Динамическая вязкость экспоненциально зависит от температуры:
η =η eEη / RT , |
(2.413) |
0 |
|
где η0 – коэффициент, который приближенно можно считать не зависящим от температуры; Eη – энергия активации вязкого течения жидкости. Коэффициент
диффузии и коэффициент поступательного трения (коэффициент сопро-
тивления) f, т.е. коэффициент пропорциональности между силой, действующей на движущееся тело, и его скоростью, связаны между собой соотношени-
ем Эйнштейна
D = |
kT |
. |
(2.414) |
|
|||
|
f |
|
|
Для перемещающегося в непрерывной среде шара радиусом r Стокс получил выражение
f =6πrη . |
(2.415) |
Подставляя уравнение (2.415) в (2.414) и переходя при этом от постоянной Больцмана к газовой постоянной, получаем уравнение Стокса – Эйнштейна:
D = |
RT |
. |
(2.416) |
|
|||
|
6πrηNA |
|
|
Движение молекулы в растворе довольно сильно отличается от движения шара в непрерывной среде. Однако, несмотря на это, уравнение (2.416) доста-
точно хорошо описывает зависимость коэффициента диффузии от разных фак-
тор, в частности от температуры. Считая ED ≈ Eη , где ED |
– энергия активации |
||||
диффузии, и подставляя (2.413) в (2.416), получаем |
|
||||
D = D e−ED / RT , |
|
|
(2.417) |
||
0 |
|
|
|
|
|
ln D = ln D − |
ED |
|
1 |
, |
(2.418) |
|
|
||||
0 |
R |
T |
|
||
|
|
||||
где
188

Х и м и ч е с к а я к и н е т и к а
D = |
RT |
|
|
. |
(2.419) |
6πrη |
N |
|
|||
0 |
A |
|
|||
|
0 |
|
|
||
Экспериментальные данные подтверждают линейную зависимость ln D −1/T . При изменении температуры на 1 K коэффициент диффузии многих веществ
меняется на 3–4%.
Первый закон Фика описывает диффузионные процессы, не зависящие от времени. Эти процессы характеризуются постоянным градиентом концентрации, который поддерживается вводом частиц (газа или растворенного вещества) в одну область и выводом из другой. Диффузионные процессы, зависящие от времени, в которых к некоторому моменту времени устанавливается некоторое распределение концентраций, а затем происходит рассредоточение без по-
полнения градиента, описывает второй закон Фика (уравнение диффузии). В
случае линейной диффузии имеем
|
∂c |
|
= D |
∂2c |
, |
|
|
(2.420) |
|
|
∂τ |
|
∂x2 |
|
|
||||
|
|
|
|
|
|
|
|
||
а при пространственной диффузии это уравнение примет вид |
|
||||||||
|
∂c |
|
= D 2c ; |
|
|
(2.421) |
|||
|
∂τ |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
2c = |
∂2c |
+ ∂2c |
+ |
∂2c |
, |
(2.422) |
|||
|
∂x2 |
∂y2 |
|
∂z2 |
|
|
|||
где 2 =∆ – оператор Лапласа.
Задавая начальные и граничные условия, можно путем интегрирования дифференциального уравнения (2.420) или (2.421) получить выражение для
скорости гетерогенного процесса, лимитируемого процессом диффузии.
В промышленных реакторах условия протекания каталитических реакций на равнодоступной поверхности катализатора, т.е. в отсутствии влияния массопереноса на скорость каталитического процесса, как правило, не соблюдаются. На скорость, селективность и кинетические закономерности гетероген- но-каталитического процесса существенное влияние оказывает перенос вещества к активной поверхности катализатора. Раздел химической кинетики, рассматривающий протекание гетерогенно-каталитических реакций совместно с процессами переноса вещества и теплоты, называется макроскопической ки-
нетикой или макрокинетикой.
Исходя из приведенных выше стадий гетерогенно-каталитического процесса и основных кинетических областей работы катализатора в нем понятно, что для адсорбции исходных веществ и реакции между ними они должны из потока газовой или жидкой фазы продиффундировать к внешней поверхности гранулы катализатора, а затем по порам гранулы к его внутренней поверхности. В пер-
189
Х и м и ч е с к а я к и н е т и к а
вом случае имеет место внешняя диффузия, а во втором – внутренняя диффу-
зия реагирующих веществ.
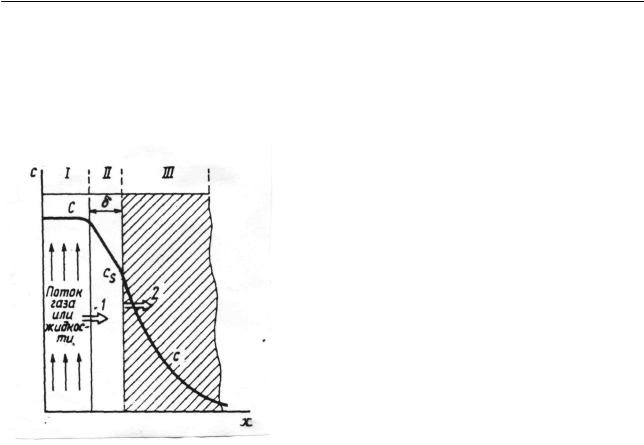
Вокруг гранулы катализатора, омываемой потоком реагента, образуется ламинарный слой (рис.2.44), толщина которого δ зависит от скорости движения жидкой или газовой фазы относительно твердой поверхности. Массоперенос через этот слой осуществляется за счет диффузии.
Рис. 2.44. Распределение концентрации реагента у внешней поверхности и внутри гранулы катализатора:
I – газовая или жидкая фазы; II – диффузный слой у внешней поверхности гранулы; III – пористая гранула; 1 – диффузионный поток реагента к внешней поверхности; 2 – поток реагента внутри гранулы катализатора
При стационарном режиме зависимость c от x линейна. Тогда градиент концентрации равен
− dc |
= |
c − cS |
, |
(2.423) |
|
||||
dx |
|
δ |
|
|
где с – концентрация в объеме газовой (жидкой) фазы, сS |
– концентрация у |
|||
внешней поверхности катализатора. Если отнести скорость диффузии [см. |
|||||
уравнение (2.411)] к единице объема катализатора Vк , то |
|
||||
v |
вн |
= |
dn |
, |
(2.424) |
|
|||||
|
V dτ |
|
|||
|
|
|
к |
|
|
где vвн – скорость внешней диффузии. Площадь внешней поверхности Sг и объем Vг шарообразной гранулы катализатора с радиусом rг можно определить по следующим выражениям:
S |
|
= 4πr2 |
; |
V |
= |
4 |
πr3 . |
(2.425) |
|
г |
г |
|
г |
|
3 |
г |
|
Учитывая (2.411), (2.423) – (2.425), имеем
190
