
Физ химия и физ т.д
..pdf
Х и м и ч е с к а я к и н е т и к а
На стадии (a)происходит гомолитический разрыв (электронная пара разрывается) ковалентной связи молекулы иода с образованием двух свободных атомов иода, обладающих неспаренным электроном (I )1. На стадии (б) I легко отрывает атом водорода от молекулы H2 . Стадия (б) реакции (2.13) значи-
тельно более вероятна, чем реакция (2.12), так как последняя связана с одновременным разрывом двух химических связей и образованием двух новых связей, в то время как на стадии (б) реакции (2.13) одновременно разрывается од-
на и образуется тоже одна химическая связь. При классическом продолжении цепной реакции (см. в 2.2.1.5.С) образовавшийся атом H должен был бы оторвать атом иода от молекулы I2 , с появлением в результате атома I , вступающего в реакцию со следующей молекулой H2 , и т.д. Однако в рассматриваемом случае (2.13) на стадии (в) происходит обрыв цепи. В сумме три последовательные стадии [стадию (б) нужно умножить на два] дают реакцию (2.12).
Приведенный пример наглядно показывает, что уравнение сложной реакции (2.12) не отражает истинный механизм реакции, которая в действительности состоит из трех элементарных стадий. В рассматриваемой реакции участвуют пять компонентов; из них два – исходные вещества ( H2 , I2 ), один – про-
дукт реакции (HI ) и два – промежуточные вещества (атомы H и I ).
В мономолекулярных реакциях участвует одна частица (молекула). К числу мономолекулярных относятся реакции, связанные с внутримолекулярным превращением – изомеризацией и распадом одной частицы на несколько других. Примером изомеризации может служить переход цис-изомера дихлорэтана
в транс-изомер: |
|
|
|
|
H |
H |
H |
|
H |
|
C = C |
→ |
C = C |
, |
Cl |
Cl |
Cl |
|
Cl |
а примером распада одной частицы – распад молекулы азометана на два свободных метильных радикала и молекулу азота:
CH3 − N = N − CH3 → 2CH3 + N2 .
Примером бимолекулярной реакции является щелочной гидролиз метилиодида, протекающий по уравнению
CH3 I + OH − →CH3OH + I − .
1 Активная частица с некомпенсированной валентностью обозначается точкой над химическим символом атома, обладающего неспаренным электроном.
11

Х и м и ч е с к а я к и н е т и к а
Перейдем к рассмотрению второго признака, лежащего в основе кинетической классификации химических реакций – к порядку реакции. Различают частный (по данному веществу) и общий порядки.
В общем случае кинетическое уравнение может иметь довольно сложный вид, но часто скорость является степенной функцией концентраций исходных веществ. Частный порядок nX реакции – это показатель степени при кон-
центрации одного из исходных веществ, участвующих в реакции, в кинетическом уравнении, а общий порядок n реакции – сумма показателей степени концентраций всех исходных веществ. При этом для простых реакций
(и элементарных стадий сложных реакций) порядок реакций определяется значениями стехиометрических коэффициентов. Так, для гомогенной простой реакции типа (2.8), кинетическое уравнение которой имеет вид (2.9), порядок, на-
пример по веществу A , есть стехиометрический коэффициент nA |
этого веще- |
ства в уравнении реакции, а общий порядок реакции равен |
|
n = nA + nB + nD . |
(2.14) |
Общий порядок реакции не превышает трех. При этом различают реакции
первого, второго и третьего порядков.
Обобщенно простые реакции или элементарные стадии сложных реакций различного порядка и их кинетические уравнения можно представить следую-
щим образом: |
n =1 |
|
|
реакции первого порядка |
|
|
|
A → Продукты |
n = 2 |
v = kc |
(2.15) |
реакции второго порядка |
|
|
|
A + B → Продукты |
(с = сA ) |
v = kcAcB |
(2.16) |
2A → Продукты |
v = kc2 |
(2.17) |
|
реакции третьего порядка |
n =3 |
v = kcAcBcD |
(2.18) |
A + B + D → Продукты |
|
||
2A + B → Продукты |
(c = cA ) |
v = kcA2 cB |
(2.19) |
3A → Продукты |
v = kc3 |
(2.20) |
При равенстве числовых значений частного и общего порядка реакции, имеющем место для кинетических уравнений (2.15), (2.17), (2.20), необходимость уточнять о каком порядке реакции идет речь отпадает.
Известны также реакции нулевого порядка. В этих реакциях скорость не зависит от концентрации реагирующих веществ, т.е. остается постоянной в течение всей реакции или ее элементарной стадии (для сложных реакций). Кине-
тическое уравнение реакции нулевого |
порядка имеет вид |
|
v = kc0 , |
или v = k . |
(2.21) |
Кинетические закономерности, определяемые порядком реакции, относят к формальной кинетике, так как порядок реакции является понятием формаль-
12

Х и м и ч е с к а я к и н е т и к а
ным. Закономерности формальной кинетики для уяснения механизма реакции теряют смысл, если механизм реакции, суждение о котором сформулировано по порядку реакции, не соответствует экспериментальным данным.
Закон действующих масс, несмотря на то, что на практике очень мало строго доказанных простых реакций, сохраняет свое важное значение и часто его называют постулатом химической кинетики для простых реакций. Это обусловлено, с одной стороны, тем, что знание хотя бы наиболее вероятного механизма протекания сложной реакции позволяет применить закон действующих масс к каждой элементарной стадии, а, с другой стороны, – применимостью этого закона к некоторым сложным реакциям, например к реакции (2.12), подчиняющейся закону действующих масс для реакций второго порядка.
Закон действующих масс выполняется при определенных условиях, которые для простой реакции заключаются в следующем [12].
1.При протекании реакции не нарушается максвелл-больцмановское распределение энергии по степеням свободы реагирующих частиц. Это условие выполняется при достаточно медленном протекании химической реакции по сравнению с физическими процессами обмена энергий (поступательной, колебательной, вращательной) от частицы к частице. Нарушение этого распределения отражается на кинетике реакции, примером чего служит рассматриваемый далее случай мономолекулярной реакции, имеющей второй порядок.
2.Изменение концентраций реагентов (исходных веществ) заметно не меняет свойств среды и физического состояния реагентов, что в жидкой фазе обычно выполняется только для сильно разбавленных растворов.
3.Химическая реакция осуществляется только за счет тепловой энергии. Если реакцию вызывают свет, электрический ток и т.д., то скорость реакции зависит от этих факторов, а закон действующих масс видоизменяется.
При моделировании химико-технологических процессов используют поня-
тие формально простых реакций. В узком смысле это сложные реакции, со-
стоящие из последовательности элементарных стадий с неустойчивыми промежуточными веществами, что позволяет формально рассматривать ее (последовательность) как одну стадию. В определенном интервале изменения концентрации исходных веществ для таких реакций часто оправдывается степенная зависимость скорости реакции от концентрации реагирующих веществ, но с показателями степени, отличными от стехиометрических. В широком
смысле любые сложные реакции, для которых кинетическое уравнение в требуемом интервале изменения концентраций может быть получено на опыте приближенно в виде степенной зависимости скорости реакции от концентрации, относят к формально простым.
Реакцию (2.8) для данного конкретного момента времени можно записать
как
xA + yB + zD → Продукты |
(2.22) |
Кинетическое уравнение в таком случае принимает вид
13

Х и м и ч е с к а я к и н е т и к а
v = kcAx cBy cDz |
(2.23) |
и называется кинетическим уравнением в алгебраической форме. Данное уравнение показывает [9], что скорость реакции в каждый момент времени
пропорциональна произведению наличных, возведенных в некоторые степени, концентраций реагирующих веществ (основной закон кинетики). В
уравнении (2.23) x , y , z – порядки реакции по компонентам A , B , D , т.е. по-
казатели степени, в которые нужно возвести концентрации, чтобы получить экспериментально наблюдаемую скорость реакции по данному веществу1.
Вопросы, связанные с кинетикой протекания сложных химических реакций, подробно будут рассмотрены в 2.2.1.5. Здесь же для полноты изложения вопроса кинетической классификации химических реакций отметим лишь следующее.
При кинетическом изучении сложных реакций применяют принцип независимости, являющийся по сути дела одним из постулатов химической кинети-
ки: если в системе протекает несколько реакций, то каждая из них подчиняется основному закону и протекает независимо от других реакций. Пол-
ное изменение системы представляет сумму этих независимых изменений. Исходя из сказанного, одной из возможных общих форм написания кинети-
ческого уравнения сложных реакций является приводимое в [1] выражение
v = kcn1cn2 cn3 |
, |
(2.24) |
||
1 |
2 |
3 |
|
|
где n1 , n2 , n3 , в отличие от nA , nB , nD |
в уравнении (2.9), есть порядки реакции |
|||
по промежуточным веществам A1 , A2 , A3 . При этом для правильного толкования уравнения (2.24) необходимо пояснить два момента, которые, к сожалению, не отмечаются авторами учебника [1]. Во-первых, концентрации промежуточных веществ могут быть выражены через концентрации исходных веществ. Вовторых, величина k в уравнении (2.24), в отличие от константы скорости k в кинетическом уравнении (2.9) для простой химической реакции (2.8), представляет собой эффективную величину, являющуюся сложным комплексом констант скоростей элементарных стадий.
Общий порядок реакции равен
|
n = n1 + n2 + n3 . |
(2.25) |
|
|
|
1 В случае обратимой реакции типа nA A + nB B R nC C + nD D, |
кинетическое уравнение в ал- |
|
гебраической форме для прямой реакции имеет вид v+ = k+cAx cBy |
(общий порядок реакции |
||||||
n = x + y ), а для обратной реакции – |
v |
− |
= k |
cx1 cy1 (общий порядок реакцииn = x |
+ y ). |
В |
|
данных уравнениях v+ ≡ vG и k+ ≡ kG – |
|
|
− C D |
1 |
1 |
|
|
скорость и константа скорости прямой реакции, |
а |
||||||
v− ≡ vH и k− ≡ kH соответственно эти же величины для обратной реакции. |
|
|
|||||
14

Х и м и ч е с к а я к и н е т и к а
Порядок реакции n может принимать дробное и даже, как уже отмечалось, нулевое значение, в частности для реакций, идущих по цепному механизму (см. 2.2.1.5.С). Одной из причин наличия дробных порядков может быть тот факт, что реакция идет по нескольким путям при получении одного и того же продукта. В результате этого порядок реакции является усредненным значением, отражающим вклад каждого из этих путей в общее выражение для скорости реакции.
К о н с т а н т ы с к о р о с т и х и м и ч е с к и х р е а к ц и й р а з- л и ч н о г о п о р я д к а и м е ю т р а з н у ю р а з м е р н о с т ь, что видно из формул (2.15) – (2.20). Исходя из размерностей величин, входящих в
эти формулы, константа скорости реакций первого порядка измеряется в c−1 ;
второго порядка – в л/ (моль с) |
|
м3 |
/ (кмоль с) |
и |
третьего порядка – в |
л2 / (моль2 с) м6 / (кмоль2 с) 1. |
|
|
|
|
|
Из сказанного ясно, |
что нельзя сопостав- |
||||
лять константы скорости реакций различного порядка, и, что при переходе
от одной единицы измерения концентрации к другой константа скорости первого порядка не изменяется.
Порядок реакции – формальное эмпирическое понятие, его находят из кинетических уравнений химических реакций, в то время как молекулярность – теоретическое понятие, она определяет фактическое число частиц, участвующих в элементарном акте химического взаимодействия.
Только для простых реакций, протекающих в одну элементарную стадию без участия посторонних молекул, молекулярность и порядок реакции совпа-
дают. Несовпадение молекулярности и порядка реакции имеет место в трех основных случаях: для сложных реакций, для гетерогенных реакций и для реакций с избытком одного из реагирующих веществ.
Для сложных реакций данное несовпадение определяется различием между кинетическим уравнением (2.23) сложной химической реакции и кинетическим уравнением (2.9) простой химической реакции (или элементарной стадии сложной химической реакции).
Так, например, мономолекулярные реакции могут иметь как первый, так и второй порядок. Элементарным актом многих гомогенных мономолекулярных реакций, протекающих в газовой фазе, является распад молекулы. Мономолекулярный распад претерпевают обычно сложные молекулы, состоящие из большого числа атомов, причем энергия активации этих реакций сравнительно велика. Дело в том, что сами по себе такие молекулы устойчивы и, прежде чем распасться, они должны приобрести избыток энергии благодаря столкновениям с другими молекулами, движущимися с большими скоростями, т.е. должны быть активированы.
1В СИ константа скорости реакций первого порядка измеряется в c−1 ; второго порядка – в м3 / (моль с) и третьего порядка – в м6 / (моль2 с).
15

Х и м и ч е с к а я к и н е т и к а
Механизм протекания мономолекулярных реакций можно приближенно (полукачественно) объяснить с помощью теории Линдемана, согласно которой мономолекулярное превращение является сложным процессом, состоящим из бимолекулярной стадии активации и мономолекулярного превращения активных частиц (подробнее см. 2.2.1.5.В). Таким образом, распад молекулы, например диссоциация ацетона:
(CH3 )CO(Г) →С2 H6(Г) + СO(Г), |
(2.26) |
идет в две стадии, причем в зависимости от соотношения скоростей этих стадий (первая – образование активных молекул и вторая – их разложение) суммарная реакция может иметь как первый, так и второй порядок.
Втех случаях, когда время между столкновениями молекул мало по сравнению со временем распада (высокое давление), часть из них дезактивируется при соударениях и не успевает распасться. Доля активных молекул остается постоянной, число их оказывается пропорциональным концентрации. Реакция, скорость которой определяется скоростью второй стадии, т.е. пропорциональна концентрации в первой степени, идет по кинетическому уравнению первого порядка. Если же время между столкновениями молекул велико по сравнению со временем, необходимым для распада возбужденной (активированной) молекулы (низкое давление), т.е. время существования активных молекул мало, то большинство их распадается, не успев дезактивироваться в результате новых столкновений. Очевидно, что в этом случае скорость реакции определяется скоростью первой стадии, т.е. скоростью активации, которая пропорциональна числу двойных столкновений (квадрату концентрации), и реакция идет по уравнению второго порядка.
Рассмотренный пример возможного несовпадения молекулярности и порядка сложных реакций наглядно привел нас еще к одному выводу, крайне важному при рассмотрении сложных реакций (см. 2.2.1.5), а именно к выводу о том, что для сложных реакций имеет место элементарная (или формально
простая) стадия, кинетические закономерности которой в основном определяют закономерности всего процесса. Такая стадия получила название
лимитирующей.
Врассмотренном примере диссоциации ацетона (2.26) при высоких давлениях лимитирующей является вторая стадия, а при низких – первая. Добавле-
ние в реакционное пространство постороннего газа ведет к тому, что молекулы примеси, участвуя в дезактивирующих столкновениях, устраняют переход реакций первого порядка в реакции второго порядка.
Прежде, чем перейти к рассмотрению двух оставшихся случаев несовпадения молекулярности и порядка химической реакции, остановимся еще раз на реакции взаимодействия молекулы водорода с молекулой иода (2.12), механизм которой выражается уравнениями (2.13), но уже в свете введенного понятия лимитирующей стадии реакции.
16

Х и м и ч е с к а я к и н е т и к а
Данная реакция состоит из последовательности элементарных стадий с неустойчивыми промежуточными веществами, что позволяет рассматривать ее как одну стадию, т.е. как формально простую бимолекулярную реакцию (2.12). Данная реакция, как уже отмечалось, подчиняется закону действующих масс для реакций второго порядка, что согласуется с наличием лимитирующей стадии (б) в сложной химической реакции (2.13). Рассматриваемая реакция явля-
ется сложной последовательной реакцией, протекающей по цепному механизму. Поэтому наиболее медленная стадия (б), являющаяся элементарной стади-
ей второго порядка, определяет кинетику и общий порядок реакции (2.12), т.е.
является лимитирующей, или скорость-определяющей стадией.
Вернемся к рассмотрению случаев несовпадения молекулярности и порядка реакции.
Молекулярность всегда не соответствует порядку реакции для гетерогенных реакций. Отмеченное становится понятным с учетом того, что при нахождении исходных веществ в различных фазах их концентрация уже не определяет число прореагировавших частиц.
И, наконец, в некоторых случаях один из компонентов реакции присутствует в таком большом избытке, что расход его в реакции практически не отражается на его концентрации. Так, например, реакция омыления сложного эфира
Катализатор |
(2.27) |
CH3COOC2 H5 + H2O →СH3COOH +C2 H5OH |
осуществляется при значительном избытке одного из исходных веществ – воды, концентрацию которой практически можно считать постоянной. Следовательно, скорость реакции (2.27) в указанных условиях описывается кинетическим уравнением
v = kcCH COOC H |
5 |
, |
(2.28) |
|
3 |
2 |
|
|
|
т.е. соответствует кинетическому уравнению первого порядка (2.15), несмотря на участие в реакции двух молекул. Таким образом, реакция (2.27) бимолекулярная, но первого порядка.
Еще одним примером бимолекулярной реакции первого порядка является взаимодействие малахитового зеленого с гидроксид-ионом в присутствии избытка основания. Кинетика данного взаимодействия изучается студентами при выполнении лабораторной работы [15].
2.2.1.3. Константа скорости реакции и период полупревращения для химических реакций различного порядка
Формальная кинетика, несмотря на ограниченные возможности, обусловленные разграничением реакций по порядку по формальному признаку (сумма показателей степеней в кинетических уравнениях химических реакций), дает возможность использовать математические зависимости для нахождения важ-
17
Х и м и ч е с к а я к и н е т и к а
нейших кинетических параметров: константы скорости и изменения концентрации реагирующих веществ с течением времени, т.е. c = f (τ).
Рассмотрим возможности формальной кинетики применительно к элементарным и формально простым гомогенным односторонним реакциям в закрытых системах1.
Как уже было показано (см. 2.2.1.2.), скорость реакции нулевого порядка
(2.21) постоянна вследствие практического постоянства концентрации
компонента или компонентов реакции. Исходя из этого понятно, что если в случае рассмотренного примера омыления сложного эфира водой в разбавленном водном растворе (2.27) применять эфир, малорастворимый в воде, и взять
его в количестве, обеспечивающем присутствие в системе эфирного слоя (избыток эфира), то расход эфира будет постоянно восполняться из эфирного слоя, а, следовательно, скорость омыления эфира сохранится постоянной, т.е.
−dc / dτ = k , v = k . |
(2.29) |
Разделив переменные и проинтегрировав, получим |
|
c = −kτ + B , |
(2.30) |
где B - постоянная интегрирования. |
τ =0 и |
Постоянную интегрирования определим из начальных условий |
c = c0 . Тогда B = c0 где c0 - концентрация исходного вещества – эфира в нашем |
|
примере. |
|
Подставляя значение B в (2.30), получаем |
|
c =c0 − kτ. |
(2.31) |
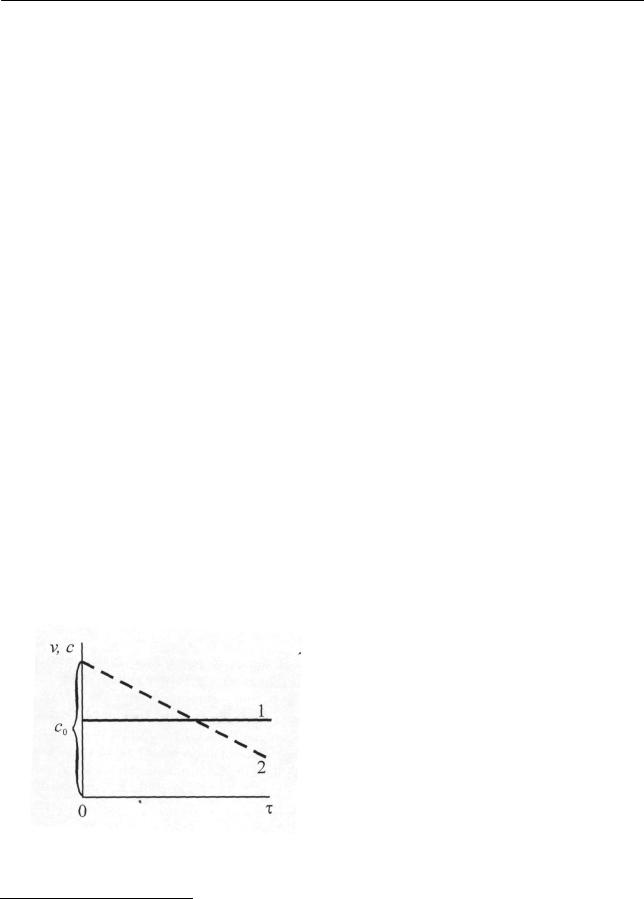
Изменение скорости реакции и концентрации исходного вещества для реакций нулевого порядка представлены на рис. 2.1.
Рис. 2.1. Изменение скорости реакции (1) и концентрации исходного вещества (2) в зависимости от времени в реакции нулевого порядка
1 Все полученные результаты относятся и к элементарным стадиям сложных реакций, протекающих в тех же условиях.
18
Х и м и ч е с к а я к и н е т и к а
Скорость реакции нулевого порядка, как следует из уравнения (2.29), есть
величина постоянная (прямая 1), а концентрация исходного вещества, как видно из уравнения (2.31), уменьшается линейно (прямая 2) по мере увели-
чения времени реакции.
Для характеристики скорости реакции наряду с константой скорости часто пользуются временем, или периодом полупреващения (полураспада в случае радиоактивных процессов) τ1/2, равным промежутку времени, в течение ко-
торого первоначальная концентрация исходного вещества снижается на-
половину, c = c0 / 2 , т.е., другими словами, реагирует половина взятого количества вещества.
Для реакции нулевого порядка время полупревращения равно |
|
τ1/ 2 =c0 / 2k. |
(2.32) |
Тогда, определяя значение k из выражения (2.32), с учетом (2.29) |
получаем |
v = k = c0 / 2τ1/ 2 , |
(2.33) |
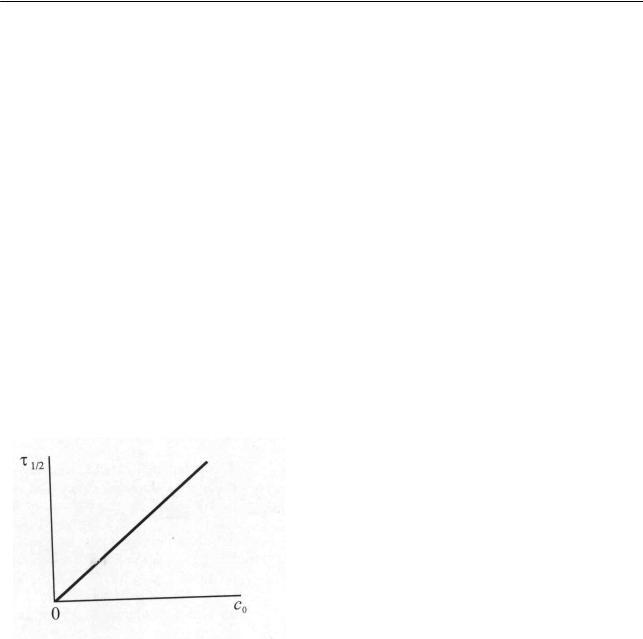
что находит графическое отображение в виде прямой, выходящей из начала координат (рис. 2.2).
Рис. 2.2. Зависимость времени полупревращения реакции нулевого порядка от начальной концентрации исходного вещества
Таким образом, можно заключить, что время полупревращения реакции
нулевого порядка прямо пропорционально начальной концентрации исход-
ного вещества (2.32), а константа скорости химической реакции численно
равна скорости реакции, причем эти величины обратно пропорциональны времени полупревращения (2.33).
Скорость реакции первого порядка, кинетическое уравнение которой оп- |
|
ределяется формулой (2.15), с учетом уравнения (2.4) равна |
|
v = −dc / dτ = kc. |
(2.34) |
Разделив переменные
19

Х и м и ч е с к а я к и н е т и к а
kdt = −dc / c |
(2.35) |
и проведя интегрирование уравнения (2.35)от 0 до τ |
(левой части) и от c0 (на- |
чальная концентрация) до c 1 (текущая концентрация) за время τ (правой части)
|
|
τ |
c |
|
|
|
|
|
|
∫kdτ = −∫dc / c, |
|
|
|
(2.36) |
|
0 |
c0 |
|
|
|
|
||
получим |
|
|
|
|
|
||
kτ = ln |
c0 |
, ln c = −kτ + ln c , |
k = 1 ln |
c0 |
. |
(2.37) |
|
|
|
||||||
|
c |
0 |
τ c |
|
|||
|
|
|
|||||
Формулы (2.37) – различные формы кинетического уравнения реакции пер-
вого порядка в интегральном виде. Их потенцирование позволяет получить зависимость текущей концентрации в экспоненциальной форме
c = c e−kτ . |
(2.38) |
0 |
|
Выражения (2.37) характеризуют зависимость концентрации исходного веще-
ства от времени процесса для реакции первого порядка. Они позволяют определить константу скорости реакции и время полупревращения, которые равны
k = ln 2 = |
0,693 |
или τ1/ 2 |
= |
0,693 |
(2.39) |
τ1/ 2 |
τ1/ 2 |
|
|
k |
|
Итак, время полупревращения реакции первого порядка не зависит от на-
чальной концентрации исходного вещества [уравнение (2.39), рис. 2.3 (б)] и обратно пропорционально константе скорости реакции (2.39).
Величина lnc , в соответствии с уравнением (2.37), обратно пропорцио-
нальна времени реакции, что отражает рис. 2.3 (а).
Рис. 2.3. Зависимость логарифма концентрации исходного вещества от времени процесса (а) и времени полупревращения от начальной концентрации исходного вещества (б) для реакции первого порядка
1Для текущей концентрации может быть использовано тождественное обозначение cτ .
20
