
Физ химия и физ т.д
..pdf
Х и м и ч е с к а я к и н е т и к а
3NH2OH → NH3 + N2 + 3 H2O,
4NH2OH → 2 NH3 + N2O + 3 H2O.
Схему параллельных гомогенных реакций в закрытой системе, когда вещество A одновременно претерпевает мономолекулярное превращение в вещества B и D, причем параллельные элементарные односторонние реакции имеют первый порядок по исходному веществу A, можно представить в виде
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v1(k1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
( |
2.109) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
A− |
→B |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v2(k2 ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
→D |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
Общая скорость изменения содержания (расходования) вещества A равна |
||||||||||||||||||||||||||||||||||||||||
сумме скоростей реакции по обоим направлениям: |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
− |
dc1 |
|
= k c |
|
|
+ k c |
|
= (k |
+ k |
|
|
)c |
, |
|
|
|
( |
2.110) |
|||||||||||||||||||
|
|
|
dτ |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
1 |
1 |
|
|
2 |
1 |
|
|
|
|
1 |
|
|
|
|
2 |
1 |
|
|
|
|
|
|
||||||||||
где c1 – концентрация вещества A. Уравнение ( |
2.110) |
после разделения пере- |
||||||||||||||||||||||||||||||||||||||
менных и интегрирования в пределах от c01 до c1 |
и от 0 до τ примет вид |
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
c |
= c |
|
e |
− k +k |
|
|
τ |
|
|
|
|
|
|
|
|
|
|
|
|
|
(2.111) |
||||||||||
|
|
|
|
|
|
|
|
|
|
( |
|
1 |
|
2 ) . |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
01 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Скорости образования (получения) веществ B и D, концентрации которых |
||||||||||||||||||||||||||||||||||||||||
соответственно c2 и c3 , равны |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
dc2 |
= k c |
|
и |
dc3 |
|
= k |
c . |
|
|
|
|
( |
2.112) |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
dτ |
|
|
1 |
1 |
|
|
|
|
|
|
dτ |
|
|
|
|
2 |
|
1 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Подставляя в (2.112) значение c1 из ( |
2.111), получаем |
|
2 ) dτ . |
(2.113) |
||||||||||||||||||||||||||||||||||||
dc |
= k c e |
( |
1 |
+k |
2 ) |
dτ |
|
и |
dc |
|
|
= k c |
|
|
e ( |
1 |
|
|||||||||||||||||||||||
2 |
|
1 |
01 |
− |
k |
τ |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
2 |
|
01 |
|
− |
k +k |
τ |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
Предполагая, что в начале реакции c02 =c03 = 0, |
|
и интегрируя эти уравнения от |
||||||||||||||||||||||||||||||||||||||
0 до c2 (или соответственно от 0 до c3 ) получаем, с учетом (2.111), следую- |
||||||||||||||||||||||||||||||||||||||||
щие уравнения: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k c |
|
|
|
|
|
|
|
− k +k |
|
τ |
|
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
c |
= |
|
1 01 |
|
1 − e |
( 1 |
|
|
2 ) |
|
|
= |
|
|
1 |
|
|
|
|
|
(c |
|
− c |
), |
( |
2.114) |
||||||||||||||
k |
+ k |
|
|
|
|
k |
+ k |
|
|
|
||||||||||||||||||||||||||||||
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
01 |
|
1 |
|
|
|
||||||||||||||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
k c |
|
|
|
|
|
|
|
− k +k |
|
τ |
|
|
|
|
|
|
k |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
c |
= |
|
2 01 |
|
1 − e |
( 1 |
|
|
2 ) |
|
|
= |
|
|
|
|
|
|
|
|
(c |
|
− c |
). |
( |
2.115) |
||||||||||||||
k |
|
|
|
|
|
k |
+ k |
|
|
|
|
|||||||||||||||||||||||||||||
3 |
|
+ k |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
01 |
|
1 |
|
|
|
||||||||||||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Разделив уравнение (2.114) |
на уравнение (2.115), получим: |
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c2 |
|
= |
k1 |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
( |
2.116) |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
41

Х и м и ч е с к а я к и н е т и к а
Легко видеть, что на трех или большем числе параллельных реакций первого порядка получится результат, сходный с (2.116). Так, если схему параллель-
ных реакций записать в виде
|
v1 |
(k1) |
|
|
|
|
|
→B |
|
|
|||
A − |
v2(k2 ) |
|
, |
(2.117) |
||
→C |
||||||
|
v3(k3 ) |
|
|
|
||
|
→D |
|
||||
|
− − − → |
|
|
|
||
то уравнение для концентрации c1 |
исходного вещества A в экспоненциальной |
|||||
форме будет иметь вид |
|
|
|
|
|
|
|
− |
k |
+k |
+k |
τ |
(2.118) |
c = c e |
( 1 |
2 |
3 ) . |
|||
1 |
01 |
|
|
|
|
|
Концентрации продуктов (c2 , c3 , c4 |
соответственно для B, C, D), при условии |
|||||
их отсутствия в исходной системе, будут относиться как константы скоростей реакций, т.е.
c2 : c3 : c4 :... = k1 : k2 : k3 :... |
(2.119) |
Так, при нитровании фенола идут три параллельные реакции первого порядка относительно фенола), а именно образование орто-, мета- и пара- нитрофенолов. Экспериментально установлено, что отношение количества трех изомеров остается постоянным в течение всего процесса: co : cм : cп =59,2 :3,3: 3,75 = ko : kм : kп. Очевидно, что с наибольшей скоростью
образуется орто-изомер, а с наименьшей – мета-изомер Введем понятие интегральной селективности процесса (реакции). Инте-
гральной селективностью процесса при наличии нескольких параллель-
ных реакций называется отношение концентрации основного (полезного) продукта к сумме концентраций всех продуктов, полученных в результате процесса, т.е. применительно к реакции (2.109)
σ = |
|
|
c2 |
|
|
|
(2.120) |
|
c |
+ c |
|
||||
|
|
|
|
||||
|
2 |
|
3 |
|
|
|
|
или, с учетом (2.116), имеем |
|
|
|
|
|
|
|
σ = |
|
|
k1 |
|
|
. |
(2.121) |
k |
+ k |
2 |
|
||||
|
|
|
|
||||
|
1 |
|
|
|
|
||
На основании выражения (2.121) селективность рассматриваемого процесса
равна соотношению константы скорости основной реакции к сумме констант скоростей основной и побочной реакций, если вещество B мы считаем основным (полезным продуктом), а вещество D – побочным продуктом (отхо-
42

Х и м и ч е с к а я к и н е т и к а
дом процесса). Для рассматриваемого процесса селективность остается постоянной на протяжении всего времени протекания двух параллельных реакций. Кинетические кривые компонентов реакции (2.109) для случая c2 >c3 , что оз-
начает k1 > k2 , т.е. для случая, когда скорость реакции получения вещества B
превышает скорость получения вещества D, приведены на рис. 2.7. В рассматриваемом случае главная реакция (как обычно) обладает большей скоростью, чем побочная (образование вещества D). Впрочем, при не слишком большом различии в скоростях главной (основной) реакцией называют реакцию, приводящую к получению нужного продукта, хотя бы она и обладала меньшей ско-
ростью.
Рис. 2.7. Кинетические кривые компонентов параллельной реакции (2.109)
Таким образом, мы нашли зависимость концентрации веществ A, B и D от времени [см. выражения (2.111), (2.114), (2.115)], считая константы скоро-
стей обеих параллельных реакций известными, т.е. решили прямую кинетическую задачу.
Для решения обратной кинетической задачи введем обозначения
k + k |
2 |
= M и |
k1 |
= N . |
(2.122) |
|
|||||
1 |
|
k2 |
|
|
|
|
|
|
|
|
Значения величин M и N рассчитываем, исходя из опытных данных, по формулам (2.123), получаемым, с учетом введенных обозначений (2.122), из уравне-
ний (2.111) и (2.116)
M = |
1 ln |
c01 |
=const и |
N = |
c2 |
=const. |
(2.123) |
|
c |
c |
|||||||
|
τ |
|
|
|
|
|||
|
|
1 |
|
3 |
|
|
||
Из системы уравнений (2.122) находим
k = |
MN |
|
и k |
2 |
= |
M |
. |
(2.124) |
|
|
|||||||
1 |
N +1 |
|
|
N +1 |
|
|||
|
|
|
|
|
||||
Проведем качественный анализ параллельной реакции, в которой вещество A2 вступает во взаимодействие с неустойчивым веществом A1 , параллельно
распадающимся с константой скорости k1 :
43

Х и м и ч е с к а я к и н е т и к а
v1(k1) |
v2(k2 ) |
(2.125) |
A1 →Продукты распада; A1 + A2 |
→B . |
|
Если в качестве исходной взята стехиометрическая смесь A1 и A2 , в конце ре- |
||
акции не будет наблюдаться 100% -ное превращение |
A2 в B. Это обусловлено |
|
нехваткой вещества A1 , которое частичное израсходуется на побочную реак-
цию первого порядка. При исследовании кинетики реакции по накоплению B или расходованию A2 через определенное время можно зарегистрировать пре-
кращение (остановку) реакции при наличии непрореагировавшего A2 . Наличие избытка A1 по сравнению с A2 в исходной смеси повышает степень превраще-
ния. Однако, как показывает строгий математический анализ, в реакционной смеси всегда останется некоторое количество непрореагировавшего A2 , кото-
рое тем меньше, чем больше взято A1 . На рис. 2.8 показано, как выглядят кинетические кривые накопления B (c3 ) при разных начальных концентрациях A1 .
Для кинетических кривых 1, 2, 3 |
наблюдается соответственно возрастание на- |
|
чальных |
концентраций A1 (c01 ), |
в то время как начальная концентрация |
A2 (c02 ) |
остается неизменной. |
|
Рис. 2.8. Кинетические кривые накопления продукта реакции B в параллельной реакции (2.125)
Рассмотренный случай иллюстрирует, по крайней мере, два важных для химии положения.
1.Превращение некоторого вещества в интересующий продукт реакции может быть неколичественным из-за протекающих в той же смеси параллельных реакций, в которых участвует само вещество, либо другие взаимодействующие с ним компоненты реакционной смеси, т.е. из-за побочных (нежелательных) реакций.
2.В реакции с участием двух компонентов, осложненной побочными превращениями какого-либо из компонентов, степень превращения одного из компонентов в интересующий продукт реакции можно увеличить, используя избыточные количества второго компонента.
Последовательные (консекутивные) реакции – это реакции, протекаю-
щие таким образом, что продукт одной стадии является исходным веществом для другой.
44

Х и м и ч е с к а я к и н е т и к а
Простым примером последовательных реакций может служить омыление диэтилоксалата едким натром, которое протекает последовательно в две стадии
COOC2 H5 |
COOC2 H5 |
|||
|
+ NaOH → |
|
|
+ C2 H5OH |
|
|
|||
COOC2 H5 |
COONa |
|||
COOC2 H5 |
COONa |
|||
|
+ NaOH → |
|
|
+ C2 H5OH |
|
|
|
||
COONa |
COONa |
|||
В последовательных реакциях, как правило, расчет зависимости концентрации от времени довольно сложен, так как для исключения концентраций промежуточных веществ приходится решать систему дифференциальных уравнений. Только для более простых реакций с последовательными стадиями первого порядка удается получить аналитические выражения для концентрации веществ в явном виде. Примером такой простой последовательной реакции может служить гомогенная реакция в закрытой системе с двумя односторонними мономолекулярными элементарными стадиями (первого порядка).
v1(k1) |
v2(k2 ) |
(2.126) |
A →P →B. |
||
В данной реакции молекула A превращается в молекулу B через образова-
ние некоторого промежуточного соединения (вещества) P. Так как соедине-
ние P может быть как достаточно устойчивой молекулой, так и ионом или свободным радикалом, то в общем случае оно называется промежуточной частицей. В соответствии с определением последовательных реакций промежуточная частица P является продуктом первой стадии и одновременно исходным реагентом второй стадии.
Обозначим |
концентрации веществ A, B, P в момент времени τ через |
c1, c2 , c3 ; v1, v2 |
и k1, k2 – соответственно скорости и константы скорости первой |
и второй стадии реакции. При нестационарном режиме протекания реакции они могут быть различны.
Рассмотрение начнем со случая, когда константы скорости обеих последовательных стадий близки между собой.
Для любого из трех компонентов рассматриваемого сложного химического превращения можно написать кинетическое уравнение. При этом следует учесть, что промежуточная частица P одновременно образуется из A по реакции первого порядка с константой скорости k1 и расходуется по реакции первого
порядка с константой скорости k2 . Поэтому кинетические уравнения запишутся в виде
45

Х и м и ч е с к а я к и н е т и к а
− |
dc1 |
= k ; |
dc3 |
= k c |
− k c ; |
dc2 |
= k c . |
(2.127) |
|
dτ |
dτ |
dτ |
|||||||
|
1 |
1 1 |
2 3 |
2 3 |
|
Для нахождения уравнений кинетических кривых в рассматриваемом случае приходится решать систему дифференциальных уравнений, одно из которых можно заменить уравнением материального баланса. Это уравнение учитывает, что взамен каждой исчезнувшей молекулы A появляется частица P, а взамен каждой исчезнувшей частицы P появляется молекула B. Следовательно,
c1 + c2 + c3 = c01 , |
(2.128) |
где c01 – начальная концентрация A в момент времени, когда P и, тем более B, еще отсутствуют.
Используя систему дифференциальных уравнений (2.127), проведем качественный анализ вида кривых процесса (2.126), приведенных на рис. 2.9.
Рис. 2.9. Зависимость концентраций исходного вещества (1), промежуточного вещества (2) и конечного продукта (3) от времени для после-
довательной |
односторонней |
реакции |
первого |
||
порядка |
( k = 0,5 c−1 |
; |
k |
2 |
= 0,3 c−1 ; |
|
1 |
|
|
|
|
c01 =1,0 моль/ м3 )
Из второго уравнения в рассматриваемой системе дифференциальных уравнений видно, что скорость накопления P, т.е. dc3 / dτ , в начальный момент вре-
мени, когда P еще отсутствует и концентрация A равна c01 , есть положительная величина. Значит, c3 возрастает во времени. Однако dc3 / dτ при этом падает,
поскольку в правой части уравнения уменьшается первый член (из-за расходования A) и увеличивается по модулю второй член (из-за накопления P). Понятно, что в некоторый момент времени эти два члена (k1c1 и k2c2 ) будут равны,
производная dc3 / dτ обратится в нуль, и дальнейшее накопление P, т.е. рост c3 , остановится. Поскольку A при этом будет продолжать расходоваться, т.е. c1 бу-
дет уменьшаться, то вслед за этим второй член станет по абсолютной величине больше первого, а значит, производная dc3 / dτ будет отрицательной и c3 , т.е.
концентрация P, начнет убывать. Следовательно, кинетическая кривая промежуточного соединения проходит через максимум (кривая 2 на рис. 2.9).
Наконец, концентрация B будет непрерывно возрастать. Вначале, как это видно из третьего уравнения в системе дифференциальных уравнений (2.127),
скорость накопления B, т.е. производная dc3 / dτ равна нулю, так как P в реак-
46

Х и м и ч е с к а я к и н е т и к а
ционной смеси отсутствует (c3 = 0). По мере роста c3 (накопления P) скорость
образования B возрастает, растет и угол наклона касательной. Кривая имеет вид, представленный на рис. 2.9 (кривая 3). Про такие кривые говорят, что они имеют участок с начальным ускорением. Это новый тип кинетических кривых, которые не встречаются у простых реакций и называются S-образными или
кривыми автокаталитического типа, так как они впервые были обнаружены у автокаталитических реакций. В этих реакциях в качестве одного из продуктов образуется вещество, являющееся катализатором реакции. По мере увеличения концентрации катализатора скорость реакции возрастает и, следовательно, реакция идет с накоплением (см.2.2.1.5.С).
Из системы дифференциальных уравнений (2.127), с использованием для упрощения уравнения материального баланса (2.128), можно получить сле-
дующие выражения, являющиеся решением прямой кинетической задачи для рассматриваемого случая:
|
|
|
|
|
|
|
|
с = с |
e−k1τ ; |
|
|
|
|
|
|
|
|
|
(2.129) |
|||||||
|
|
|
|
|
|
|
|
1 |
|
|
01 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
c3 = |
|
c01k1 |
|
|
(e−k1τ |
|
− e−k2τ ); |
|
|
|
|
(2.130) |
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
k |
2 |
− k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
2 |
|
|
|
|
−k τ |
|
|
|
|
|
k |
|
−k τ |
|
(2.131) |
||
c |
= c |
|
1 |
− |
|
|
|
|
|
|
|
e |
1 |
+ |
|
|
|
1 |
|
e |
2 |
|
; |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
2 |
01 |
|
|
|
k2 − k1 |
|
|
|
|
|
k2 − k1 |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
τmax = |
|
|
|
lnγ |
|
|
|
; |
|
|
|
|
|
(2.132) |
|||||||
|
|
|
|
|
k |
(γ |
−1) |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
γ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2.133) |
||||||||
|
|
|
|
|
|
c |
max3 |
= c γ 1−γ , |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
01 |
|
|
|
|
|
|
|
|
|
|
|
|
||
где τmax , cmax3 - координаты максимума на кинетической кривой для промежуточного вещества P (рис. 2.9, кривая 2), определенные из условия dc3 / dτ =0 ;
γ = k2 / k1 .
Из уравнений (2.132) и (2.133) следует, что на графике в безразмерных координатах k1τ и c3 / c01 максимум на кинетической кривой для промежуточного вещества P зависит только от γ = k2 / k1 и не зависит от абсолютного значения констант скорости стадий. С ростом отношения k2 /k1 максимум на кинети-
ческой кривой для промежуточного вещества становится ниже и смещается к началу координат (рис. 2.10).
47

Х и м и ч е с к а я к и н е т и к а
Рис. 2.10. Зависимость концентрации промежуточного вещества от времени для различных значений γ :
1 − 0,04; 2 − 0,6; 3 −10;c01 =1,0 моль/ м3
Следует также обратить внимание на то, что S-образная кривая для продукта реакции B имеет точку перегиба, причем время перегиба τпер равно времени
достижения максимальной концентрации для P, т.е. τпер =τmax (рис. 2.9), в чем
легко убедиться, приравнивая вторую производную d 2c2 / dτ2 нулю. До точки
перегиба, как уже отмечалось, накопление вещества B происходит как бы с ускорением (сначала его концентрация увеличивается медленно, затем быстрее), а после точки перегиба – с замедлением. Скорость второй стадии реакции (2.126) в начальный период времени, когда концентрация промежуточного
продукта мала, также мала. Накопление конечного продукта будет протекать медленно и концентрация его в растворе может быть настолько низкой, что ее очень трудно определить аналитически, продукт реакции как бы отсутствует в растворе. Этот период реакции называется индукционным. Длительность его зависит от величины γ и чувствительности аналитического метода обнаруже-
ния продуктов реакции. В рассматриваемом случае индукционный период, который, как уже отмечалось, может быть обусловлен и другими причинами, является результатом последовательной реакции.
Решением обратной кинетической задачи для рассматриваемого случая являются выражения
|
|
k |
= 1 ln |
c01 |
|
|
(2.134) |
|||
|
|
|
c |
|||||||
|
|
1 |
|
τ |
|
|
|
|||
|
|
|
|
|
|
1 |
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
k |
2 |
= |
|
1 |
ln |
|
c01 |
. |
(2.135) |
|
τ |
|
|
||||||||
|
|
max |
|
|
c |
|
||||
|
|
|
|
|
|
max3 |
|
|||
Рассмотрим закономерности протекания последовательных реакций в двух крайних случаях: 1. k2 k1 (величина γ очень мала, а, следовательно, проме-
жуточный продукт P относительно устойчив) и 2. k1 k2 (величина γ очень
велика, а, следовательно, промежуточный продукт P крайне неустойчив).
1. При k2 k1 в первой элементарной стадии последовательной реакции (2.126) устанавливается состояние, близкое к равновесному:
48

Х и м и ч е с к а я к и н е т и к а
v (k |
) |
|
v2(k2 ) |
|
||
1 1 → |
(2.136) |
|||||
A← P →B , |
||||||
v−1(k−1) |
|
|
||||
причем |
|
|
|
|
|
|
|
c3 |
|
= |
c03 |
= K , |
(2.137) |
|
|
|
|
|||
|
c1 |
|
|
c01 |
1 |
|
|
|
|
|
|
||
так как при τ = 0 в системе также присутствует промежуточное вещество в концентрации, соответствующей равновесному состоянию.
Для второй стадии кинетическое уравнение имеет вид
v |
2 |
=v = − |
dc3 |
= k c . |
(2.138) |
|
|
||||||
|
|
dτ |
2 |
3 |
|
|
|
|
|
|
|
|
|
В результате интегрирования |
|
выражения (2.138), с учетом |
c03 = K1c01 и |
|||
c1 = c3 / K1 , получаем |
|
|
|
|
|
|
c3 = K1c01e−k2τ ;
c1 = c01e−k2τ .
Из материального баланса находим концентрацию c2 вещества B
c01 + c03 = c1 + c2 + c3
или
c2 = (c01 + c03 )−(c1 + c3 )= c01 (K1 +1)− c1 (K1 +1)=
= (K1 +1)(c01 − c1 ).
(2.139)
(2.140)
(2.141)
(2.142)
Отсюда, с учетом (2.140), получаем |
|
c2 = (K1 +1)c01 (1 − e−k2τ ). |
(2.143)(2.143) |
Таким образом, кинетика реакции (2.136) определяется только второй стадией, а константа скорости первой стадии k1 не входит в выражения (2.139), (2.140),
(2.143) для зависимости концентрации реагентов A, P и B от времени.
Врассматриваемом случае скорость образования промежуточного вещества значительно выше скорости его расходования, и согласно (2.133) величина
cmax3 может быть близка к c01 (рис. 2.11). С некоторого момента времени, несколько большего τmax , членом e−k1τ в уравнении (2.130) можно пренебречь по сравнению с членом e−k2τ . Тогда, с учетом k2 − k1 −k1 , имеем
c |
c e−k2τ . |
(2.144) |
3 |
01 |
|
49
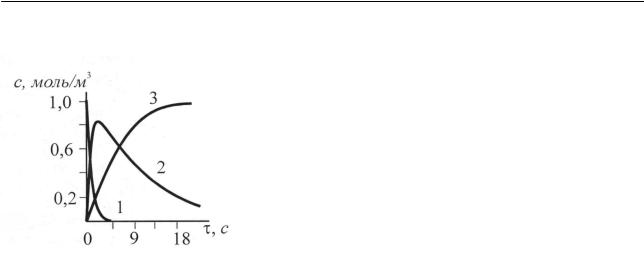
Х и м и ч е с к а я к и н е т и к а
Следовательно, последовательная реакция будет протекать как обычная реакция первого порядка.
Рис. 2.11. Зависимость концентраций исходного вещества (1), промежуточного вещества (2) и продукта реакции (3) для последовательной реакции первого порядка при k2 k1
(k1 = 2,0 c−1; k2 = 0,1 c−1; c01 =1,0 моль/ м3 )
Втех случаях, когда промежуточное вещество является целевым, то увеличение его выхода может быть достигнуто увеличением k1 , что возможно осу-
ществить, например, введением в реакционную систему селективного катализатора, увеличивающего скорость первой стадии при неизменной скорости второй. Тот же эффект достижим и путем изменения температуры, если температурная зависимость скоростей стадий различна.
2. При k1 k2 состояние, близкое к равновесному, устанавливается во второй элементарной стадии последовательной реакции (2.126):
v |
|
k |
|
|
v2(k2 ) |
|
2 |
( 1) |
|
→ |
(2.145) |
||
A →P← B . |
||||||
|
|
|
|
|
v−2(k−2 ) |
|
Считаем, что |
|
|
|
|
|
|
|
|
c2 |
= |
k2 |
= K2 , |
(2.146) |
|
|
c3 |
|
|||
|
|
|
k−2 |
|
||
где K2 – константа равновесия для второй элементарной стадии, т.е. в этой ста-
дии устанавливается квазиравновесное состояние (см. 2.2.1.5.B). Для исходного вещества A уравнение кинетической кривой описывается, очевидно, как и для реакции (2.126), выражением (2.129), а, следовательно
|
c01 − c1 = c01 (1 − e−k1τ ). |
(2.147) |
|||||||||
Из уравнения материального баланса (2.128) |
находим |
|
|||||||||
c |
+ c |
= c |
1 |
+ |
|
c2 |
|
= c |
− c . |
(2.148) |
|
|
|
||||||||||
2 |
3 |
3 |
|
|
|
c3 |
01 |
1 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Отсюда, с учетом (2.146) и (2.147), получаем |
|
|
|||||||||
|
|
|
c |
|
(1 − e−k1τ ) |
|
(2.149) |
||||
|
c3 = |
01 |
|
||||||||
|
K2 +1 |
|
|||||||||
50
