
Физ химия и физ т.д
..pdf
Х и м и ч е с к а я к и н е т и к а
через изменение концентраций, показателей степеней и константы скорости. Возможное изменение скорости реакции вследствие двух первых причин, как показывает опыт, незначительно. Следовательно, основное влияние температура оказывает на скорость реакции. Поэтому, говоря о влиянии температуры на скорость реакции, обычно имеют ввиду изменение константы скорости.
В соответствии с правилом Вант-Гоффа увеличение температуры на 10 K вызывает увеличение скорости реакции в 2–4 раза. Отношение кон-
стант скоростей, найденных для данной реакции при температурах T +10 K иT
kT +10 / kT =γ |
(2.223) |
называют температурным коэффициентом скорости реакции. Понятно, что согласно правилу Вант–Гоффа температурные коэффициенты скоростей ре-
акций лежат в пределах от 2 до 4.
Температура редко изменяется ровно на 10 K . Поэтому для практических
расчетов обычно используют отношение констант скоростей при любых двух температурах, выражая его через температурный коэффициент
kT2 |
=γ |
T2 −T1 |
(2.224) |
||
10 |
, |
||||
k |
|||||
|
|
|
|
||
T1
при этом понятно, что показатель степени может быть положительной, отрицательной, целой или дробной величиной.
Следует помнить, что правило Вант–Гоффа дает полуколичественную характеристику влияния температуры. Оно приближенно и было установлено для реакций в растворах, протекающих при сравнительно низких температурах (273 – 373 K). С повышением температуры величина γ не остается постоянной,
а уменьшается, стремясь к единице.
Значительно точнее зависимость константы скорости от температуры выражает уравнение Аррениуса, которое в наиболее общем виде выглядит следующим образом:
ln k = − B |
+ C , |
(2.225) |
T |
|
|
в котором B и С являются, по идее, независящими от температуры постоянными, характерными для данной реакции. Данная формула оправдывается на очень большом экспериментальном материале, относящемся к самым различным реакциям как в газах, так и в растворах. Первоначально она и была получена Аррениусом эмпирически. В то же время, уравнение (2.225) можно полу-
чить и теоретически, исходя как из термодинамических предпосылок, так и из теорий самой кинетики (см. 2.3).
Теоретически Сванте Аррениус свое уравнение обосновал, исходя из термодинамического соотношения – изобары или изохоры Вант-Гоффа. Это соот-
91

Х и м и ч е с к а я к и н е т и к а
ношение1, как известно (см., например [2]), выражает зависимость константы равновесия от температуры:
d ln Kc |
= |
q |
. |
(2.226) |
|
RT 2 |
|||
dT |
|
|
||
Рассмотрим первоначальный термодинамический вывод уравнения Аррениуса, хорошо позволяющий понять сущность влияния температуры на скорость реакции, в котором было сделано четыре допущения.
Основное допущение Аррениуса состояло в том, что реагировать могут не все молекулы, а лишь находящиеся в особой таутомерной форме или ак-
тивной модификации. Образование этой активной, реакционноспособной формы молекул происходит из обычных нормальных молекул эндотермически (с поглощением теплоты Ea 2). Для примера рассмотрим реакцию
A → B ,
скорость которой выражается эмпирическим уравнением
dcB |
= kcA , |
(2.227) |
|
dτ |
|||
|
|
где k – наблюдаемая константа скорости, увеличивающаяся с температурой. По Аррениусу, эту реакцию следует записать в виде двух последовательных процессов:
A + Ea R Aакт → B . |
(2.228) |
Второе допущение Аррениуса состоит в том, что образование активной модификации рассматривается как обратимая реакция, а концентрация этой модификации всегда соответствует термодинамическому равновесию и в принципе ее можно выразить через константу равновесия. При этом, очевидно, предполагается, что превращение активной модификации в конечный продукт происходит относительно медленно, поэтому равновесная концентрация успевает восстанавливаться.
Третье из рассматриваемых допущений: концентрация активной модификации всегда мала и ее образование практически не влияет на концентрацию исходных молекул. Исходя из этого, константу равновесия первой обратимой стадии реакции (2.228) можно представить в упрощенном виде:
1 Данное соотношение здесь приводится в обобщенном виде (2.226). При этом следует пом-
нить, что теплота q в случае изобарно-изотермических процессов равна изменению энтальпии ∆H , а в случае изохорно-изотермических процессов – изменению внутренней энергии ∆U . Другими словами, для изобары имеем qp = ∆H , а для изохоры – qV = ∆U .
2 Использование для теплоты данного обозначения, принятого для энергии, является корректным, так как теплота является одним из способов передачи энергии [2].
92

Х и м и ч е с к а я к и н е т и к а
Kc = |
cA |
= KccA . |
(2.229) |
|
акт |
или cA |
|||
|
||||
|
cA |
|
|
|
|
|
акт |
|
|
К константе равновесия Kc можно применить уравнение изохоры (2.226):
d ln Kc |
= |
Ea |
. |
(2.230) |
|
RT 2 |
|||
dT |
|
|
||
И, наконец, четвертое допущение, содержащее утверждение о том, что образовавшаяся активная модификация превращается в конечный продукт со скоростью, не зависящей от температуры. Следовательно, по Аррениусу, роль температуры сводится к смещению равновесия между нормальными и активными молекулами. При этом, так как процесс образования активных молекул является эндотермическим, то в соответствии с принципом Ле Шателье – Брауна [2] повышение температуры будет приводить к увеличению их концентрации.
Вышесказанное позволяет записать скорость образования продукта следующим образом:
dcdτB =const cAакт =const KccA .
Сравнение данного выражения для dcB / dτ с выражением (2.227) позволяет
заключить, что по Аррениусу наблюдаемая на опыте константа скорости k выражается произведением константы равновесия Kc и некоторой другой кон-
станты, не зависящей от температуры, т.е.
k =const Kc . |
(2.231) |
После логарифмирования и дифференцирования (2.231)по температуре получаем
d ln k |
= |
d ln Kc |
, |
(2.232) |
dT |
|
|||
|
dT |
|
||
в котором производную, стоящую справа, можно заменить ее выражением из (2.230). Получается соотношение
d ln k |
= |
Ea |
, |
(2.233) |
|
dT |
RT 2 |
||||
|
|
|
являющееся уравнением Аррениуса в дифференциальной форме.
Величину Ea , представляющую собой теплоту образования1 одного моля активной модификации по уравнению (2.228) и имеющую размерность1 энер-
1 Здесь принято термодинамическое обозначение – положительной считается поглощаемая теплота.
93

Х и м и ч е с к а я к и н е т и к а
гии на моль, Аррениус назвал теплотой или энергией активации. На данном этапе рассмотрения вопроса энергию активации можно определить, как избы-
точное количество энергии по сравнению с некоторой средней величиной, которым должна обладать реагирующая частица, чтобы осуществить хи-
мическую реакцию. Из соображений, которые станут ясны позже (см. 2.2.2.3.),
Ea обычно называют экспериментальной (опытной) или аррениусовской
энергией активации2.
Проинтегрируем (2.233), считая Ea = const:
ln k = − |
Ea |
+ C , |
(2.234) |
|
RT |
||||
|
|
|
где C – постоянная интегрирования, не зависящая от температуры. Сравнение уравнения (2.234) с эмпирическим уравнением Аррениуса (2.225) дает
B = |
Ea |
или E = BR . |
(2.235) |
|
|||
|
R |
a |
|
|
|
|
Часто уравнение Аррениуса представляют в следующей экспоненциальной форме, потенцируя3 соотношение (2.234):
k = e−Ea / RT +C = eC e−Ea / RT =100,4343C e−Ea / RT . |
(2.236) |
Константа скорости, следовательно, выражается произведением предэкспоненциального множителя, не зависящего в первом приближении от температуры, и экспоненты, определяющей зависимость от температуры. Обычно для предэкспоненциального множителя4 вводят обозначение
A =100,4343C .
Таким образом, окончательно уравнение Аррениуса в экспоненциальной форме принимает следующий вид:
k = Ae−Ea / RT . |
(2.237) |
Известны различные способы определения Ea и A в уравнении Аррениуса
по опытным данным (см., например [12]). Мы рассмотрим два наиболее распространенных, а именно: аналитический и графический методы. Оба этих метода основываются на знании значений константы скорости реакции при раз-
1В качестве единицы измерения энергии активации наиболее часто используют единицу измерения, приводящуюся в справочной литературе [16] для теплоты образования, т.е.
кДж/моль.
2Строго говоря, опытная энергия активации равна аррениусовской энергии активации только в случае постоянства предэкспоненциального множителя.
3Потенцирование (нем. Potenzieren, от Potenz – степень) – действие, заключающееся в нахождении числа, алгебраического или иного выражения по его логарифму.
4Величина 0,4343 в показателе степени предэкспоненциального множителя – значение lg e .
94

Х и м и ч е с к а я к и н е т и к а
личных температурах. Для получения этих значений обычно экспериментально определяют скорость реакции при нескольких температурах, и если известен
кинетический закон реакции при одной температуре (например v = kc1n1c2n2 c3n3 ), то вычисляют константу скорости реакции при разных температурах:
ki = |
|
vi |
|
, |
(2.238) |
cn1cn2 cn3 |
|||||
1 |
2 |
3 |
|
|
|
где vi иki – скорость и константа скорости реакции при i-той температуре. При
этом изменением концентрации исходных веществ обычно пренебрегают. Оба рассматриваемых метода базируются на логарифмической форме уравнения
(2.237)
ln k =ln A − ERa T1 .
Аналитический метод. По этому методу уравнение для температур T1 иТ2
ln k1 =ln A − Ea 1
R T1
ln k2 =ln A − Ea 1
R T2
и первое уравнение вычитают из второго:
ln k |
|
−ln k |
= |
Ea |
|
1 |
− |
1 |
|
или |
ln |
k2 |
= |
Ea |
|
1 |
2 |
|
|
|
|
|
|
|
|
|
|||||||
|
1 |
|
R |
|
|
|
|
|
k1 |
|
R |
|
||||
|
|
|
|
T1 |
|
T2 |
|
|
|
T1 |
||||||
Отсюда
(2.239)
(2.239) записывают
− |
1 |
|
(2.240) |
|
. |
||||
T2 |
||||
|
|
|
|
|
E |
a |
= R |
ln k2 − ln k1 |
= |
RT1T2 |
ln |
k2 |
|
|
|
|
(2.241) |
||||||||||||
|
|
|
|
|
|
|
T2 −T1 |
|
|
|
|
|||||||||||||||
|
|
|
|
1 |
− |
1 |
|
|
|
k1 |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
T1 |
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
или при переходе к десятичным логарифмам |
|
|
|
|
|
|
|
|||||||||||||||||||
E |
a |
= 2,303R |
lg k2 − lg k1 |
= 2,303 |
RT1T2 |
lg |
k2 |
|
(2.242) |
|||||||||||||||||
|
T2 −T1 |
|
||||||||||||||||||||||||
|
|
|
|
1 |
− |
1 |
|
|
|
|
|
|
|
k1 |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
T1 |
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Предэкспоненциальный множитель A рассчитывают из формулы |
|
|||||||||||||||||||||||||
|
|
|
|
|
ln A =ln k + |
Ea |
|
1 |
|
|
|
|
|
|
|
(2.243) |
||||||||||
|
|
|
|
|
R T |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
95
Х и м и ч е с к а я к и н е т и к а
или при использовании десятичных логарифмов |
|
||||
lg A = lg k + 0,4343 |
Ea |
|
1 |
. |
(2.244) |
|
|
||||
|
R T |
|
|||
Графический метод. Аналитический метод определения Ea ненадежен,
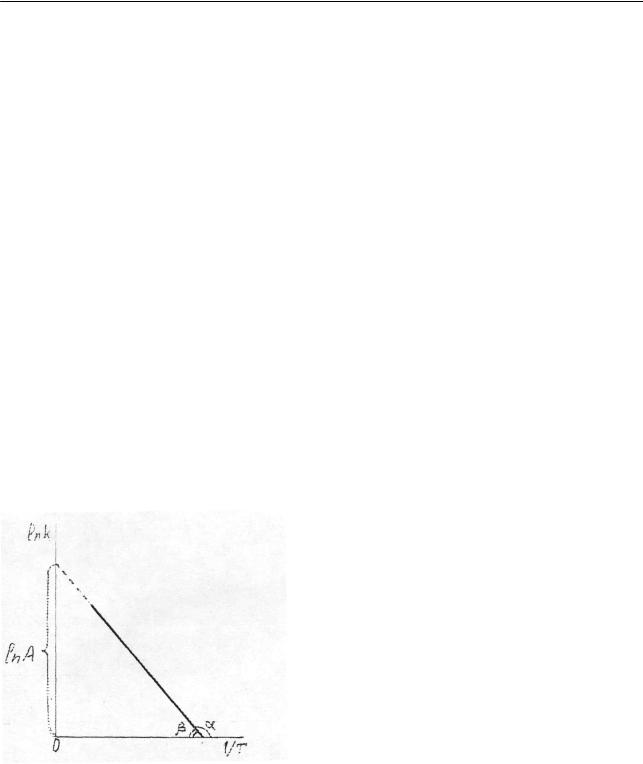
так как основан на использовании лишь двух значений константы скорости. Более точно энергию активации определяют по значениям константы скорости при нескольких температурах. Согласно уравнению (2.239) функция
ln k = f (1/T ) должна на графике дать прямую линию. Практически строят график зависимости ln k (илиlg k ) от обратной температуры (рис. 2.23). Отрезок, отсекаемый прямой на ординате, равен ln A (илиlg A), а Ea определяется из тангенса угла наклона:
tgα = −tgβ = − |
Ea |
или tg |
β = |
Ea |
. |
|
R |
|
|
||||
|
|
|
R |
|
||
Отсюда |
|
|
|
|
|
|
Ea = −Rtgα = Rtgβ |
|
|
|
(2.245) |
||
или, при построении графика в координатах lg k −1/T , |
|
|||||
Ea = −2,303Rtgα = 2,303Rtgβ . |
(2.246) |
|||||
Рис. 2.23. Определение энергии активации и предэкспоненциального множителя по уравнению Аррениуса
Энергия активации элементарных химических реакций колеблется в пределах 80–240 кДж/моль, а реакций с участием атомов и радикалов – от нескольких единиц до 60 кДж/моль. Как правило, реакции с энергией активации менее 20 кДж/моль протекают чрезвычайно быстро.
Определение, данное величине Ea Аррениусом, уже говорит о том. что
энергию активации можно связать с тепловым эффектом (энтальпией) реакции ∆H . В связи с этим необходимо рассмотреть изменение энергии в ходе элемен-
96

Х и м и ч е с к а я к и н е т и к а
тарного акта химической реакции. Для этого кратко остановимся на понятиях
элементарная стадия и элементарный акт химической реакции с энергети-
ческих позиций (более подробно эти вопросы будут освещены в 2.2.2.4).
Элементарная стадия химической реакции – это сумма элементарных актов химического превращения при одновременном сближении (столкновении) нескольких (обычно двух) частиц. В процессе элементарной стадии энергия связей перераспределяется между атомами с образованием активированного комплекса с его последующим распадом и получением новых частиц. В случае мономолекулярного акта образование активированного комплекса происходит за счет перераспределения энергии между связями атомов внутри молекулы, как следствие ее активации в результате внешних воздействий.
В исходном состоянии вещества обладают одним запасом энергии (внутренней энергии), в конечном состоянии – другим. В ходе химического превращения достигается некоторое промежуточное, так называемое переходное состояние, когда одни связи растянулись, но еще не разорвались, а новые связи только еще образуются. Это промежуточное образование называется активи-
рованным комплексом.
Активированный комплекс в переходном состоянии находится на вершине потенциального барьера (рис. 2.24, схема 2), что обусловливает неустойчивость его состояния. Поэтому активированный комплекс нельзя называть промежуточной частицей. Последняя, хотя и неустойчива, но все же находится в неглубокой потенциальной яме (рис. 2.24, схема 1). Активированный комплекс находится в состоянии непрерывного образования и разрушения в процессе перехода через потенциальный барьер (рис. 2.24, схема 2).
Рис. 2.24. Схема, поясняющая различие между промежуточной частицей
(1) и активированным комплексом (2)
Поясним сказанное на примере реакции между иодом и водородом(2.12). Данная реакция, как уже отмечалось (см. 2.2.1.2), является сложной. Ее меха-
97
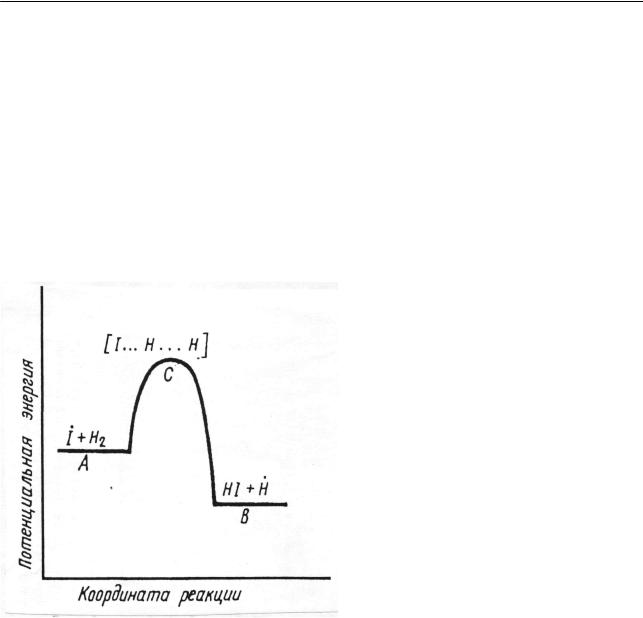
Х и м и ч е с к а я к и н е т и к а
низм отражают элементарные стадии (2.13), из которых стадия (б) является
лимитирующей. С учетом протекания элементарного акта через переходное состояние элементарную стадию (б) реакции (2.13) можно записать в виде
I + H − H → I …H …H → I − H + H . |
(2.247) |
Схематически изменение энергии при протекание элементарного акта (2.247) представлено на рис. 2.25. На этом рисунке по оси абсцисс отложена
величина, характеризующая протекание элементарного акта, «координата реакции», так называемый «путь реакции». В рассматриваемом случае это может быть, например, расстояние между двумя атомами водорода. Для более сложных частиц это понятие менее наглядно.
Рис. 2.25. Схематическое изображение элементарного акта в элементарной стадии взаимодействия атома иода с молекулой водорода
В общем случае координатой реакции, характеризующей состояние системы, может служить химическая переменная, используемая в термодинамической теории химического сродства (см., например [1]). Химическая перемен-
ная ξ – отношение изменения числа молей компонента в химической ре-
акции к его стехиометрическому коэффициенту, которое одинаково для всех компонентов и характеризует полноту реакции (иначе – число пробе-
гов или координату реакции). Химическая переменная равна нулю в начале реакции и становится равной единице в случае, когда все исходные вещества превратятся в продукты реакции. Следовательно, в пределах одного пробега химическая переменная может принимать значения от 0 до 1.
Вернемся к рассмотрению элементарного акта (2.247) в элементарной стадии (б) реакции (2.13). При сближении атома иода и молекулы водорода связь между атомами водорода растягивается, а между атомами водорода и иода об-
98
Х и м и ч е с к а я к и н е т и к а
разуется. На это требуется затрата энергии, и энергия системы из трех атомов увеличивается. В вершине потенциального барьера С (рис. 2.25) имеем переходное состояние и активированный комплекс из трех атомов. В ходе дальнейшего протекания элементарного акта расстояние между атомами водорода увеличивается и, наконец, химическая связь между ними совсем разрывается, а новая связь H − I образуется. Изложенное позволяет сделать следующее обобще-
ние: при протекании элементарного акта преодолевается один (и только один) энергетический барьер.
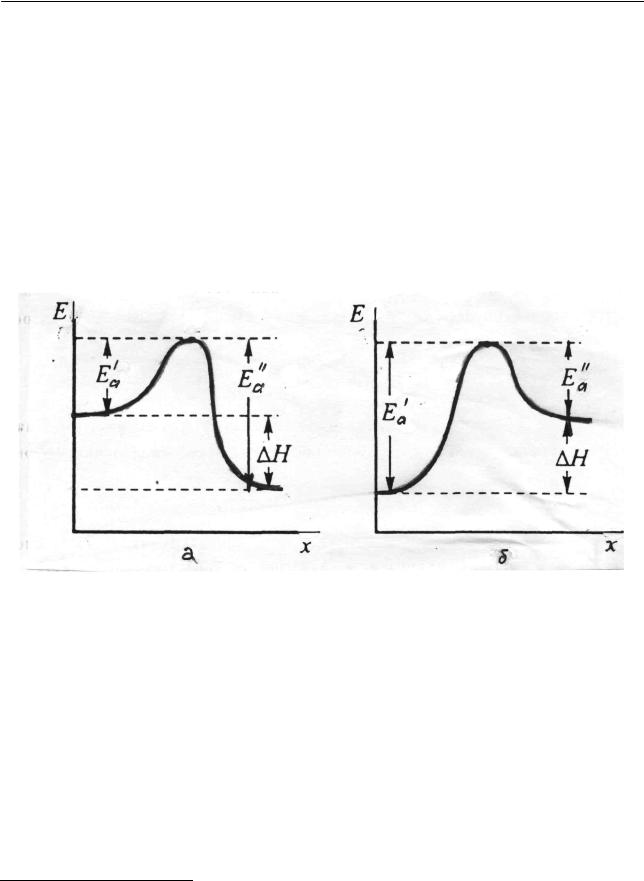
Рассмотренные понятия позволяют нам вернуться к вопросу о взаимосвязи энергии активации с энтальпией реакции. Энергия реакционной системы долж-
на пройти через максимум – потенциальный (энергетический) барьер, кото-
рый, как было показано, она преодолевает в ходе элементарного акта химической реакции. Величина барьера соответствует энергии активации (рис. 2.26).
Рис. 2.26. Связь между энергией активации прямой Ea′ и обратной Ea′′ реак-
ций и тепловым эффектом (энтальпией) реакции ∆H для экзотермического (а) и эндотермического (б) процессов (x – координата реакции)
Обратимость элементарной реакции заключается в том, что элементарные акты обратной реакции осуществляются по тому же пути, что и для прямой реакции, т.е. система проходит через те же самые промежуточные состояния, но в обратном направлении. Это является следствием более общего положения, из-
вестного в физике как принцип микроскопической обратимости. Таким обра-
зом, активированный комплекс для прямой и обратной реакции один и тот же.1 Если через Ea′ и Ea′′ обозначить соответственно энергии активации прямой
и обратной реакций, то тепловой эффект реакции равен
1 По принципу микроскопической обратимости частицы активированных комплексов прямой и обратной реакций имеют одно и то же строение, но отличаются направлением движения ядер по координате реакции.
99

Х и м и ч е с к а я к и н е т и к а
∆H = Ea′ − Ea′′. |
(2.248) |
Для экзотермической реакции Ea′ < Ea′′ [рис. 2.26 (а)] ∆H <0, для эндотермической реакции Ea′ > Ea′′ [рис. 2.26 (б)] и ∆H >0.
На основании представлений о потенциальном барьере уточним определе-
ние энергии активации. Энергия активации – это избыточное количество
энергии, которым должна обладать реагирующая частица для преодоления потенциального барьера, разделяющего исходное и конечное состояние системы.
Следует еще раз особо подчеркнуть, что все рассмотренные представления характерны для простых реакций или элементарных стадий сложных реакций.
Иногда зависимость константы скорости от температуры более сложная, чем в соответствии с уравнением Аррениуса. Как это, например, показано на рис. 2.27, такая зависимость свидетельствует о сложном характере реакции, а именно о том, что она состоит из двух или нескольких реакций, различно зависящих от температуры. График, подобный показанному на рис. 2.27, следует интерпретировать как состоящий из двух пересекающихся прямых с разными
Рис. .2.27. Влияние температуры на скорость сложной реакции:
1 – преобладает реакция с меньшей Ea , 2 – преобладает реакция с большей
Ea
угловыми коэффициентами −Ea / R . Такого рода график был получен в опытах
Норриша и Райдилла при изучении взаимодействия водорода и серы. Было установлено, что в реакционном сосуде одновременно присутствовали жидкая сера и ее пары. При этом выяснилось, что водород взаимодействует с серой в обоих агрегатных состояниях. Для реакции взаимодействия водорода с газообразной серой Ea значительно больше. Следовательно, участок 2 на рис. 2.27
соответствует гомогенной реакции.
Рассмотренный выше пример является частным случаем сложных реакций. В общем случае энергия активации для реакций, состоящих из нескольких элементарных стадий, является функцией энергий активации Ea отдельных ста-
дий. Поэтому для сложных реакций, не подчиняющихся уравнению Аррениуса (рис.2.28), используют приведенную величину, называемую эффективной, или
эмпирической энергией активации.
100
