- •Влияние различных факторов на црп Влияние температуры
- •Влияние концентрации инициатора
- •Влияние концентрации мономера
- •Влияние давления
- •Влияние примесей
- •Роль кислорода при црп
- •Ионная полимеризация (ип)
- •Катионная полимеризация (кп)
- •Механизм кп
- •Кинетика катионной полимеризации
- •Анионная полимеризация
- •Механизм ап
- •I Инициирование ап
- •II Рост цепи
- •III Способы дезактивации активного центра (ограничение роста цепи)
- •Влияние различных факторов на аП
- •Ионно-координационная полимеризация (икп)
- •Оксидно-металлические катализаторы (омк)
- •Сополимеризация
- •Свободнорадикальная сополимеризация
- •Ионная сополимеризация
- •Ступенчатая (миграционная) полимеризация
- •Другие примеры мп
- •Полимеризация циклов
- •Полимеризация циклов в присутствии активаторов
- •Влияние концентрации активатора на скорость полимеризации и молекулярную массу полимера
- •Влияние температуры на скорость полимеризации и молекулярную массу полимера
- •Ионная полимеризация циклов
- •Катионнная полимеризация циклов
- •Полимеризация циклических простых эфиров
- •Анионная полимеризация циклов
- •Поликонденсация (пк)
- •Некотрые важнейшие примеры пк
- •Влияние строения мономеров на способность к пк см. В курсе «СиРсм»
- •Равновесная пк
- •Молекулярно-массовое распределение при пк
- •Поликонденсационное равновесие
- •Влияние различных факторов на скорость пк и молекулярную массу полимера Влияние концентрации и соотношения мономеров
- •Влияние примесей монофункциоанльных соединений
- •Влияние температуры
- •Влияние катализатора
- •Способы проведения равновесной пк
- •Неравновесная пк
- •Способы проведения мфпк
- •Особенности мфпк
- •Акцепторно-каталитическая (низкотемпературная) пк
- •Трехмерная пк
- •Совместная пк
- •Блок-сополимеры Способы получения
- •Привитые сополимеры
- •Химические превращения полимеров (хпп)
- •Особенности химических реакций полимеров
- •Рассмотрим эти взаимодействия:
- •II Конформационные эффекты
- •III Надмолекулярные эффекты
- •II Полимераналогичные превращения
- •1 Деструкция
- •II хпп приводящие к изменению молекулярной массы
- •1 Сшивание макромолекул (структурировние)
- •2 Отверждение смол
Влияние примесей
Примеси, способные взаимодействовать с растущим макрорадикалом, могут обрывать реакционную цепь, снижая скорость полимеризации и молекулярную массу полимера. Поэтому мономеры должны быть тщательно очищены от таких примесей.
Роль кислорода при црп
Особое место в процессах ЦРП занимает кислород поглощаемый мономером из атмосферы. В зависимости от природы мономера и условий полимеризации присутствие кислорода может замедлять или ускорять полимеризацию. Замедляя фотополимеризацию винилацетата, кислород ускоряет фотополимеризацию стирола. Полимеризация винилхлорида, инициированная перекисью бензоила, в атмосфере азота протекает быстрее, чем в атмосфере кислорода.
Это двойственное поведение кислорода объясняется его способностью образовывать с мономером или реагирующими радикалами пероксиды или гидропероксиды:
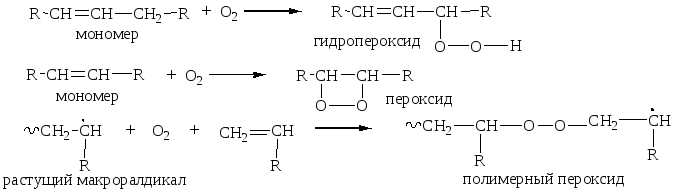
Если полученные пероксиды устойчивы, их образование дезактивирует мономер или растущую цепь и процесс полимеризации замедляется. Если же они нестойки и легко разлагаются с образованием свободных радикалов, полимеризация ускоряется. В последнем случае кислород можно использовать в качестве инициатора.
Очень часто кислород образует с
расщепленными радикалами перекисные
радикалы, типа
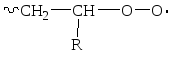 ,
активность которых недостаточна для
присоединения молекулы мономера, но
они легко рекомбинируют между собой
или соединяются с другими веществами,
имеющимися в реакционной среде.
Образующиеся при этом полимеры
низкомолекулярны.
,
активность которых недостаточна для
присоединения молекулы мономера, но
они легко рекомбинируют между собой
или соединяются с другими веществами,
имеющимися в реакционной среде.
Образующиеся при этом полимеры
низкомолекулярны.
Т.к. протекающие процессы, обусловленные присутствием кислорода, трудно учесть, то часто полимеризацию проводят в среде инертного газа.
Термодинамика ЦРП см 3 лекцию курса «Строение и реакционная способность мономеров»
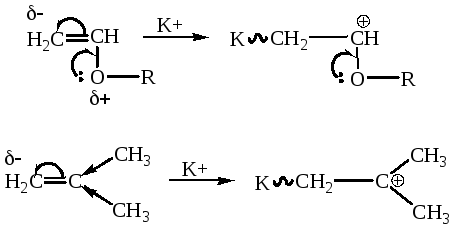
Ионная полимеризация (ип)
Ионная полимеризация протекает в присутствии катализаторов, которые в отличии от инициаторов не расходуются в процессе полимеризации и не входят в состав полимера.
Разрыв двойной связи происходит по гетеролитическому механизмус образованием либо катиона, либо аниона и полимеризация идет по цепному механизму.
В зависимости от знака заряда различают полимеризацию катионнуюианионную. Если при ионной полимеризации реакция роста цепи сопровождается координацией мономера на поверхности катализатора, то полимеризация называетсяионно-координационной.
Особенности ИП:
Высокая координирующая способность катализатора приводит к образованию линейных макромолекул регулярного строения, а в ряде случаев и стереорегулярного.
Полученные полимеры характеризуются высокой молекулярной массой и узким ММР.
Энергия активации ИП ниже чем ЦРП, поэтому ИП идет при более низких температурах, часто отрицательных, с очень высокой скоростью.
Функция катализатора не ограничивается только участием в реакции инициирования: катализаторы влияют на реакцию роста и обрыва цепи, участвует в реакциях передачи цепи. Это определяет кинетику процесса. При ЦРП инициатор не оказывает влияние на структуру полимера.
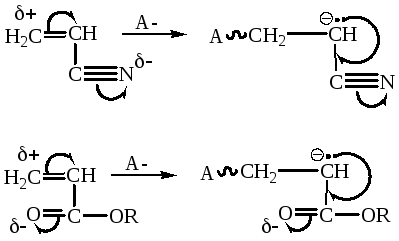
ИП характеризуется ярко выраженной селективностью. Мономеры, содержащие электронодонорные заместители участвуют в катионной полимеризации, а электроноакцепторные – в анионной.
|
Катионная полимеризация: заместители стабилизируют карбокатион. |
Анионная полимеризация: заместители стабилизируют карбоанион. |
Но для стирола, когда сопряжение стабилизирует и катион, и анион, возможна как катионная, так и анионная полимеризация:
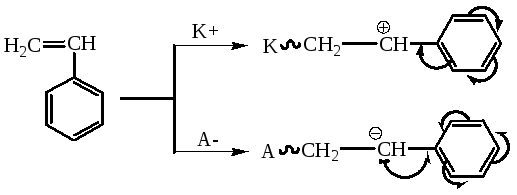
В некоторых случаях ИП отсутствуют реакции обрыва и передачи цепи. В этом случае образуются т.н. «живущие» полимеры, макромолекулы которых сохраняют активные центры (после исчерпания всего мономера) и способны к присоединению новых порций мономера, т.е. к продолжению роста цепи.
Активные центры при ионной полимеризации состоят из растущего иона (R+илиR-) и противоиона (А-или К+). Стабильность и структура ионной пары зависят от их свойств и сольватирующей способности растворителя при сильной сольватации ноны могут быть изолированы друг от друга. Различают три основные формы существования ионов в растворе:
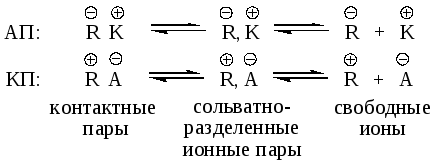
Свободные ноны характеризуются гораздо большей активностью, чем ионные пары, поэтому реакционная способность активных центров при ионной полимеризации в отличие от радикальной ИП в значительной степени зависит от свойств реакционной среды.
Часто устойчивость карбониевых ионов и карбанионов настолько мала, что они практически вовсе не образуются или, если образуются, быстро разрушаются. Вместе с тем в присутствии растворителей, сольватирующих их с выделением значительной энергии сольватации, или при достаточно низких температурах стабильность ионов возрастает настолько, что они успевают присоединиться к мономеру и вызвать полимеризацию. Хотя при этом желательны растворители высокой полярности с максимально возможной энергией сольватации, многие из них неприменимы, так как они (например, вода, спирты) разлагают большинство ионных катализаторов или, как кетоны, образуют с ними прочные комплексы, что препятствует инициированию полимеризации. Кроме того, используемые растворители должны оставаться жидкими при температуре реакции, иногда находящейся ниже — 100° С. Этим требованиям отвечают такие сравнительно малополярные растворители, как хлористый метил, пентан и нитробензол, в которых обычно и проводят ионную полимеризацию. В подобных растворителях ионы представляют собой не изолированные частицы, а находятся в виде прочно связанных ионных пар, состоящих из растущего иона и иона противоположного заряда (противоион), причем расстояние между ними растет с увеличением сольватирующей способности растворителя.