
- •1.Предмет и задачи. Методы. Теория и эксперимент.
- •Методы физического исследования: опыт, гипотеза, эксперимент, теория
- •2.Системы отсчета. Путь, перемещение, траектория материальной точки (мт).
- •3.Основные кинематические характеристики движения матер. Точки, твердого тела:
- •9)Определение деформации. Виды деформации.
- •10)Характеристики деформации. Законы Гука, модуль Юнга, графики диффузии. Энергия упр.Диффузии.
- •11.Механическая система. Импульс механической системы. Закон сохранения импульса.
- •12. Центр масс. Центр тяжести механической системы. Закон движения центра масс.
- •13.Уравнение движения тел переменной массы. Уравнение Мещерского. Уравнение Циолковского.
- •14.Энергия, работа, мощность. Кинетическая и потенциальная энергия.
- •15.Закон сохранения энергии. Графическое представление энергии.
- •16.Применение закона сохранения на примере удара абсолютно упругих и неупругих тел.
- •17.Вращательное движение абсолютно твердого тела. Момент инерции. Вычисление моментов инерции сплошного цилиндра, полого цилиндра, шара, стержня.
- •19.Момент силы. Уравнение динамики вращательного движения твердого тела.
- •20.Момент импульса. Уравнение момента. Закон сохранения закона импульса.
- •Основные задачи молекулярной физики.
- •24. Опытные законы идеального газа. Уравнения Клапейрона-Менделеева.Процесс, который проходит при постоянной температуре, называется изотермическим. , ( - масса газа )
- •25. Барометрическая формула. Распределение Больцмана.
- •28. Работа и теплота. Пнт.
- •29. Теплоёмкости. Классическая теория теплоёмкостей. Закон Джоуля.
- •36. Энтропия. Свойства энтропии, изменение энтропии при изопроцессах.
- •41. Теплопроводность в газах
- •42.Соотношение между коэффициентами диффузии ( ), теплопроводности ( ) и вязкости ( ).
- •44. Напряженность электростатического поля.
- •2)Поле конденсатора
- •50. Поле объемно заряженного шара.
- •51. Диполь в электрическом поле
- •52. Циркуляция вектора напряжённости е эл.Поля
- •53. Потенциал электростатического поля.
- •54. Напряжённость как градиент потенциала.
- •55. Потенциал в простейших электрических полях.
- •56. Электроёмкость уединённого проводника.
- •57. Электроёмкость простых конденсаторов.
- •60. Энергия электростатического поля.
- •63. Сторонние силы. Электродвижущая сила и напряжение.
- •64. Закон Ома для однородного участка цепи. Сопротивление проводников. Последовательное и параллельное соединение проводников.
- •66. Закон Ома в дифференциальной форме и для неоднородного участка цепи.
- •67. Разветвлённые цепи. Правила Кирхгофа для разветвлённых цепей.
28. Работа и теплота. Пнт.
![]()
![]()
![]() ,
,
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]() ,
,
![]() ,
,
![]()
Следовательно,
работу нельзя рассматривать как функцию
состояния системы бессмысленно говорить
о работе, которая обладает система в
том или ином состоянии. Таким образам
![]() означает не приращение, а некоторую
элементарную работу, совершенную
системой.
означает не приращение, а некоторую
элементарную работу, совершенную
системой.
![]()
Теплота
есть мера изменения той части внутренней
энергии, которая обусловлена хаотичностью
движения частиц. Теплота, получаемая
или отдаваемая системой, зависит от
пути перехода, поэтому
![]() не является дифференциалом функции
параметров системы.
не является дифференциалом функции
параметров системы.
Итак, процесс совершения системой работы и процесс передачи тепла –это 2 качественно различные формы передачи энергии. Работа проявляется в передаче энергии упорядоченного движения, а теплота –в передаче энергии хаотического движение частиц.
Число, показывающее отношение единицы мех. Работы к единицы теплоты, называется механическим эквивалентом теплоты.
Мех.
систему в сост. 1, обладает внутренней
энергий
![]() ,
,
![]() если к системе подводится теплота,
если к системе подводится теплота,
![]() если отводится.
если отводится.
![]() если система выполняет работу против
внешних сил и наоборот.
если система выполняет работу против
внешних сил и наоборот.
![]() -закон
сохранения энергии в дифференциальной
форме.
-закон
сохранения энергии в дифференциальной
форме.
![]() -
интегральная форма.
-
интегральная форма.
Полное
количество теплоты
![]() ,
полученное системой, идет на превращение
ее внутренней энергии и на совершение
работы под внешней средой.
,
полученное системой, идет на превращение
ее внутренней энергии и на совершение
работы под внешней средой.
![]()
![]() ,
,
![]()
![]()
![]()
![]() ,
,
Вечным двигателем 1-го рода называют машину, которая способна была бы совершать работу, не затрачивая при этом никакой энергии и не получая из вне тепла, потому ПНТ: нельзя построить периодически действующий двигатель, которые совершал бы большую работу, чем количество сообщенной ему из вне энергии. Иными словами, двигатель 1-го рода невозможен.
29. Теплоёмкости. Классическая теория теплоёмкостей. Закон Джоуля.
Эксперимент
и теоретические расчеты привили, что
теплоёмкость тел зависит от их химического
состава массы и термодинамического
состояния, а также от вида процесса
изменение состояние тел при сообщении
ему теплоты
![]() .
.
Теплоёмкость
–отношение сообщенного телу количества
тепла
к вызванному этим процессом повышению
температуры
![]() .
.
![]() измеряется
в
измеряется
в
![]()
![]()
Удельная
теплоёмкость
![]() - физическая величина, равна количество
теплоты, необх. нагревания тела массой
1 кг на 1К.
- физическая величина, равна количество
теплоты, необх. нагревания тела массой
1 кг на 1К.
![]()
Молярная
теплоёмкость
![]() - количество теплоты, необх. для нагревания
1 моля вещества на 1К.
- количество теплоты, необх. для нагревания
1 моля вещества на 1К.
![]()
![]()
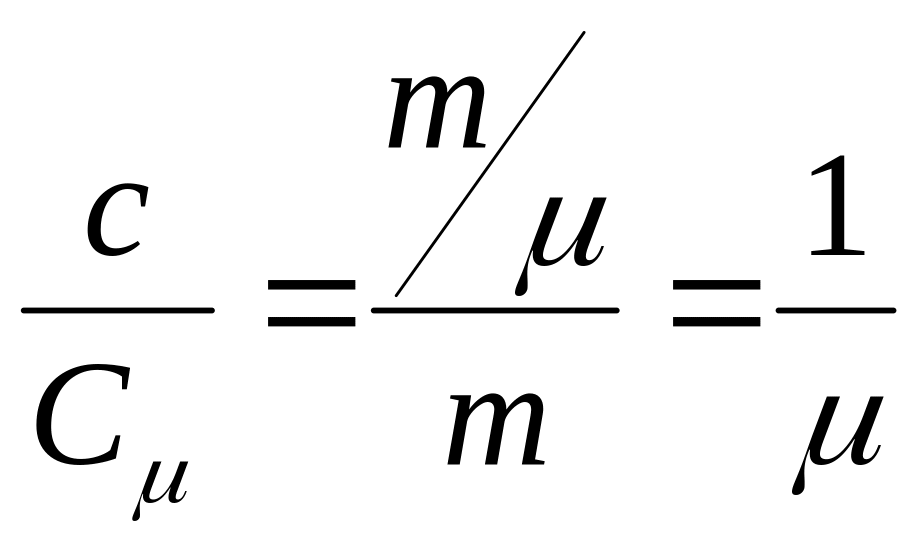
![]()
![]() ,
,
![]()
![]()
![]()
![]()
![]() .
.
Молярная теплоёмкость газа при постоянном объеме равен изменению внутренней энергии 1моля газа при повышении его температуры на 1К.
![]()
Для идеального газа теплоёмкость есть величина постоянная.
![]()
![]()
![]() -закон
Джоуля.
-закон
Джоуля.
Внутренняя энергия идеального газа зависит только от абсолютной температуры.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() -уравнение
Роберта-Майера.
-уравнение
Роберта-Майера.
Уравнение
Майера при том, что
![]() всегда больше
всегда больше
![]() на величину молярной газовой постоянной.
Это объясняет тем, что при нагревании
газа при постоянном давлении требуется
еще дополнить количество теплоты на
совершение работы расширения газа, т.к.
постоянство давления обеспечивается
увеличения объема газа.
на величину молярной газовой постоянной.
Это объясняет тем, что при нагревании
газа при постоянном давлении требуется
еще дополнить количество теплоты на
совершение работы расширения газа, т.к.
постоянство давления обеспечивается
увеличения объема газа.
![]()
![]()
![]()
![]() – 1-ат.
– 1-ат.
![]()
![]() – 2-ат.
– 2-ат.
![]()
![]() – 3-ат.
– 3-ат.
30. Применение ПНТ к изопроцессам.
И зохорный
процесс.
зохорный
процесс.
, ,
![]() .
.
Изобарный процесс.
![]()
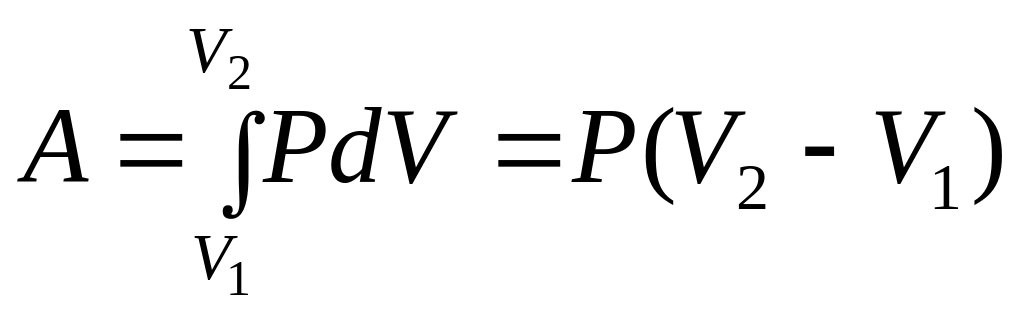
![]()
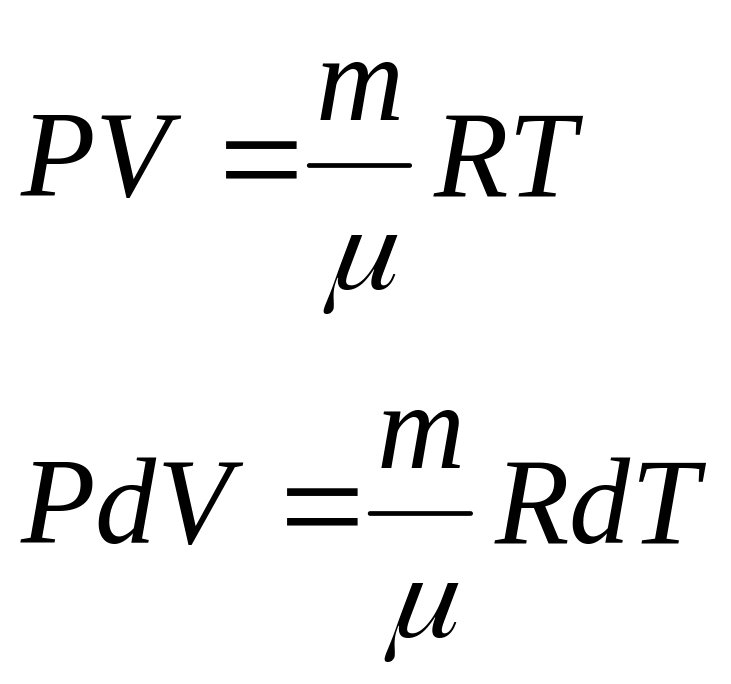
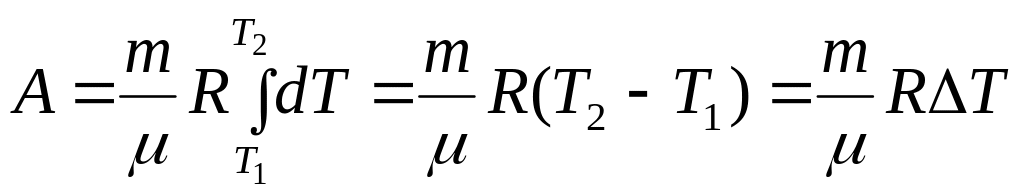
![]()
![]()
![]() ,
,
![]() численно
равна работе по расширению 1-го моля
идеального газа при нагревании его на
1К при изобарном процессе.
численно
равна работе по расширению 1-го моля
идеального газа при нагревании его на
1К при изобарном процессе.
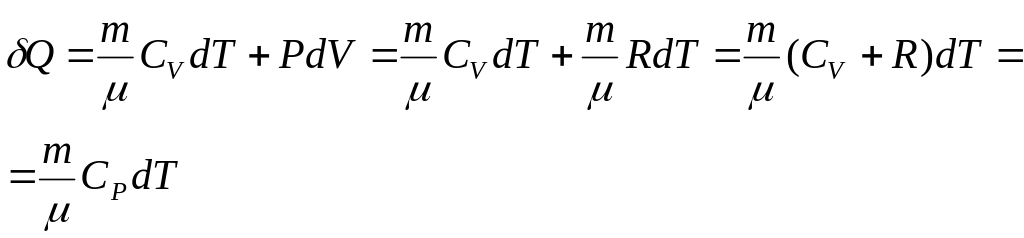
Изотермический процесс.
,
![]()
![]()
![]() ,
,
![]()
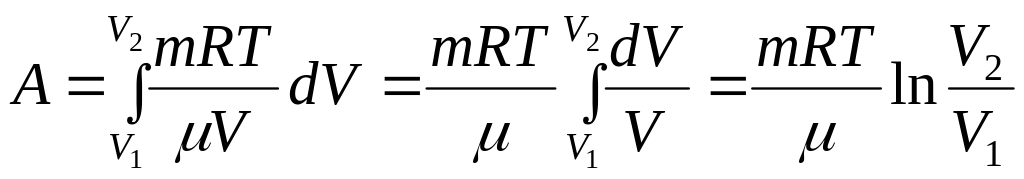
![]()
![]()
![]()
31.Адиобатный процесс. Уравнение Пуассона. Работа при адиабатном процессе. Адиабатическим называется процесс, при котором отсутствует теплообмен (δQ=0) между системой и окружающей средой. К адиабатическим процессам можно отнести все быстропротекающие процессы. Например, адиабатическим процессом можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько велика, что обмен энергией между волной и средой произойти не успевает. Адиабатические процессы применяются в двигателях внутреннего сгорания (расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т. д.
Из первого начала термодинамики (δQ=dU+δA) для адиабатического процесса следует, что δA=-dU (1), т. е. внешняя работа совершается за счет изменения внутренней энергии системы.
Для
произвольной массы газа имеем: pdV=-![]() dT
(2)
.
Продифференцировав уравнение состояния
для идеального газа pV=
dT
(2)
.
Продифференцировав уравнение состояния
для идеального газа pV=![]() RT,
получим
pdV+Vdp=
RT,
получим
pdV+Vdp=![]() RdT
(3)
RdT
(3)
![]() ,
,
![]() .
Исключим температуру T:
.
Исключим температуру T:
![]() .
Разделив
переменные и учитывая, что
.
Разделив
переменные и учитывая, что
![]() ,
,
![]() найдем dp/p=-γdV/V.
Интегрируя это уравнение в пределах от
р
найдем dp/p=-γdV/V.
Интегрируя это уравнение в пределах от
р![]() до
р2
и
соответственно от
до
р2
и
соответственно от
![]() до
до
![]() ,
,
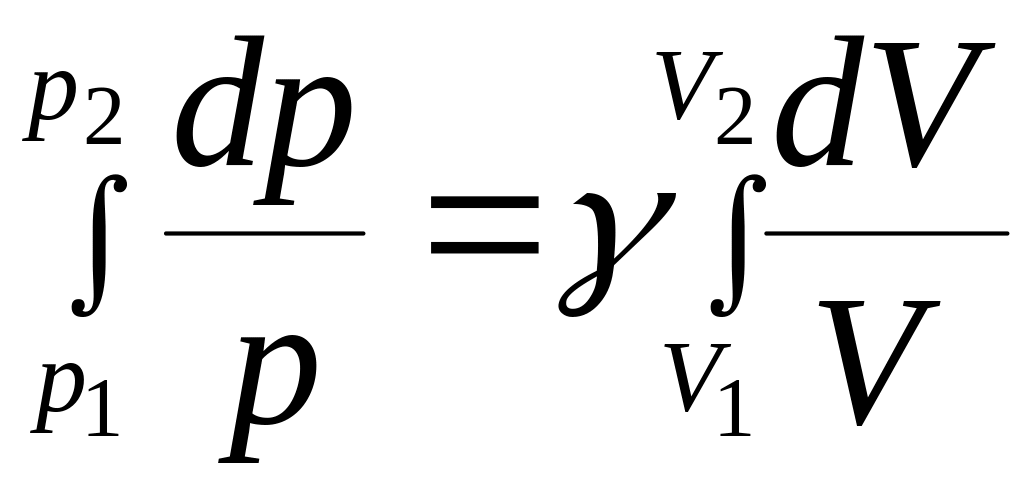 ,
,
![]() а
придем к выражению
а
придем к выражению
![]() -уравнение
адиабата, или
-уравнение
адиабата, или
![]() .
Так
как состояния 1 и 2 выбраны произвольно,
то можно записать
.
Так
как состояния 1 и 2 выбраны произвольно,
то можно записать
![]() =const
(4). Полученное
выражение есть уравнение адиабатического
процесса, называемое также уравнением
Пуассона.
=const
(4). Полученное
выражение есть уравнение адиабатического
процесса, называемое также уравнением
Пуассона.
Для перехода к переменным Т, V или p, T исключим из (4) с помощью уравнения Клапейрона — Менделеева
pV=
RT,
![]() ,
,
![]() соответственно
давление или объем:
соответственно
давление или объем:
![]() =const
(5),
=const
(5),
![]() =const
(6). Выражения
(4) — (6) представляют собой уравнения
адиабатического процесса.
В этих уравнениях безразмерная величина
=const
(6). Выражения
(4) — (6) представляют собой уравнения
адиабатического процесса.
В этих уравнениях безразмерная величина
![]() (7)
(7)
называется показателем адиабаты (или коэффициентом Пуассона).
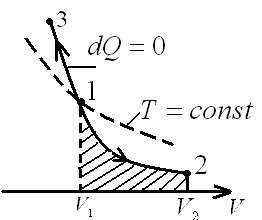 иаграмма
адиабатического процесса (адиабата) в
координатах р, V
изображается
гиперболой. На рисунке
видно, что адиабата (р
иаграмма
адиабатического процесса (адиабата) в
координатах р, V
изображается
гиперболой. На рисунке
видно, что адиабата (р![]() =
const)
более крута, чем
изотерма (р
=
const)
более крута, чем
изотерма (р![]() =
const).
Это объясняется тем, что при адиабатическом
сжатии 1,3 увеличение
давления газа обусловлено не только
уменьшением его объема, как при
изотермическом сжатии, но
и повышением температуры.
Вычислим работу, совершаемую газом в
адиабатическом процессе. Запишем
уравнение (1) в виде δA=-
=
const).
Это объясняется тем, что при адиабатическом
сжатии 1,3 увеличение
давления газа обусловлено не только
уменьшением его объема, как при
изотермическом сжатии, но
и повышением температуры.
Вычислим работу, совершаемую газом в
адиабатическом процессе. Запишем
уравнение (1) в виде δA=-![]() dT.
dT.
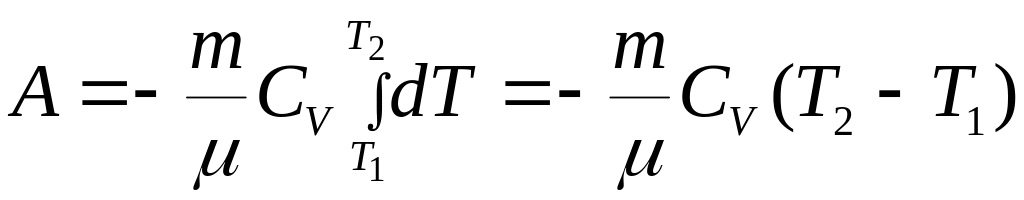
Если
газ адиабатический расширяется от
объема
до
![]() ,
то
его температура уменьшается
от Т1
до
Т2
и
работа расширения идеального газа A=
,
то
его температура уменьшается
от Т1
до
Т2
и
работа расширения идеального газа A=![]() (
Т1-Т2)
(8).
(
Т1-Т2)
(8).
![]() ,
,
![]() ,
,
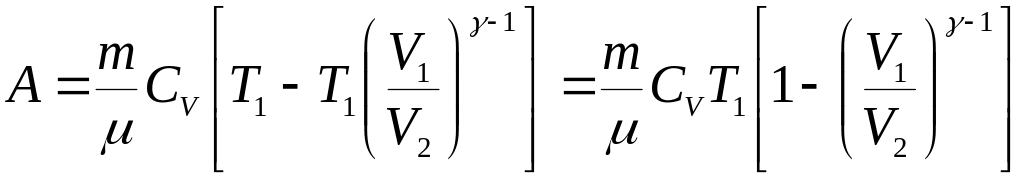 ,
,
![]() ,
,
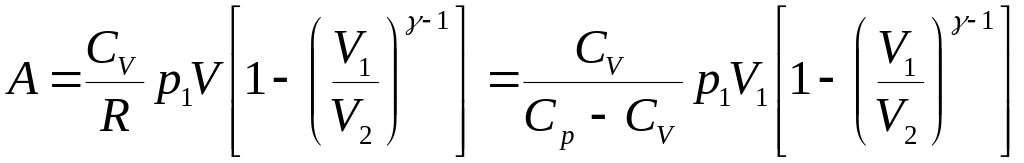 ,
,
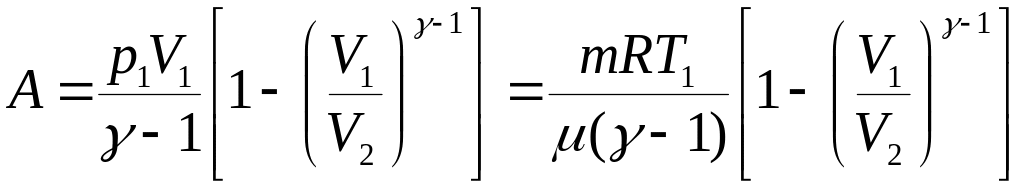
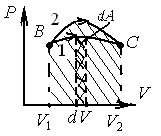
Работа, совершаемая газом при адиабатическом расширении 1,2 (определяется площадью, заштрихованной на рис.1), меньше, чем при изотермическом. Это объясняется тем, что при адиабатическом расширении происходит охлаждение газа, тогда как при изотермическом — температура поддерживается постоянной за счет притока извне эквивалентного количества теплоты.
32.Процессы: равновесные и неравновесные, обратимые и необратимые. Любой равновесный процесс является обратимым. Обратимость равновесного процесса, происходящего в системе, следует из того, что ее любое промежуточное состояние есть состояние термодинамического равновесия; для него «безразлично», идет процесс в прямом или обратном направлении. Реальные процессы сопровождаются диссипацией энергии (из-за трения, теплопроводности и т. д.), которая нами не обсуждается.
Как в конспекте:
Процесс
– переход системы из 1-го равновесного
состояния в другое, т.е от 1-ых значений
параметров
![]() к другим
к другим
![]() .
.
Равновесный процесс –процесс, состоит из ряда следующих друг за другом равновесных состояний. Равновесным процессом может быть только бесконечно медленный процесс.
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении, причем если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является
необратимым.
Обратимые процессы — это идеализация реальных процессов. Их рассмотрение важно по двум причинам: 1) многие процессы в природе и технике практически обратимы; 2) обратимые процессы являются наиболее экономичными; имеют максимальный термический коэффициент полезного действия (к.п. д), что позволяет указать пути повышения к. п. д. реальных тепловых двигателей.
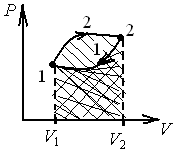
33.Круговой
процесс (цикл). Работа цикла. Термический
коэффициент полезного действия.
Круговым
процессом (или циклом) называется
процесс, при котором система, пройдя
через
ряд состояний, возвращается в исходное.На
диаграмме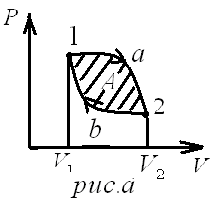
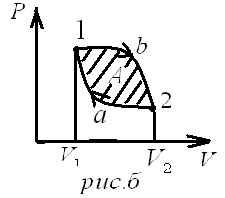 процессов цикл изображается
замкнутой кривой. Цикл, совершаемый
идеальным газом, можно разбить
на процессы расширения (1-2)
и
сжатия (2-1) газа. Работа расширения
(определяется
площадью фигуры 1a2
1)
положительна
(dV>0),
работа сжатия (определяется площадью
фигуры 2a1
процессов цикл изображается
замкнутой кривой. Цикл, совершаемый
идеальным газом, можно разбить
на процессы расширения (1-2)
и
сжатия (2-1) газа. Работа расширения
(определяется
площадью фигуры 1a2
1)
положительна
(dV>0),
работа сжатия (определяется площадью
фигуры 2a1![]() 2)
отрицательна
(dV
<0). Следовательно, работа,
совершаемая газом за цикл, определяется
площадью, охватываемой замкнутой кривой.
Если за цикл совершается положительная
работа
2)
отрицательна
(dV
<0). Следовательно, работа,
совершаемая газом за цикл, определяется
площадью, охватываемой замкнутой кривой.
Если за цикл совершается положительная
работа
![]() >0
.Цикл
протекает по
часовой стрелке, то он называется прямым
(рис. а),
если
за цикл совершается отрицательная
работа
<0
(цикл
протекает против часовой стрелки), то
он называется
обратным (рис. б).
>0
.Цикл
протекает по
часовой стрелке, то он называется прямым
(рис. а),
если
за цикл совершается отрицательная
работа
<0
(цикл
протекает против часовой стрелки), то
он называется
обратным (рис. б).
Прямой цикл используется в тепловых двигателях — периодически действующих двигателях, совершающих работу за счет полученной извне теплоты. Обратный цикл используется в холодильных машинах — периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой.
В
результате кругового процесса система
возвращается в исходное состояние и,
следовательно,
полное изменение внутренней энергии
газа равно нулю. Поэтому первое
начало термодинамики для кругового
процесса Q=ΔU+A=A
(1)
т. е.
работа, совершаемая за цикл, равна
количеству полученной извне теплоты.
Однако в результате кругового процесса
система может теплоту как получать, так
и
отдавать, поэтому
![]()
где
(![]() —
количество теплоты, полученное системой,
—
количество теплоты, полученное системой,
![]() — количестве теплоты, отданное
системой. Поэтому термический коэффициент
полезного действия для кругового
процесса
— количестве теплоты, отданное
системой. Поэтому термический коэффициент
полезного действия для кругового
процесса
![]() (2)
(2)
34. ВНТ.
Первое начало термодинамики, выражая закон сохранения и превращения энергии, не позволяет установить направление протекания термодинамических процессов. Кроме того, можно представить множество процессов, не противоречащих первому началу, в которых энергия сохраняется, а в природе они не осуществляются. Появление второго начала термодинамики связано с необходимостью дать ответ на вопрос, какие процессы в природе возможны, а какие нет. Второе начало термодинамики определяет направление протекания термодинамических процессов.
Второе начало термодинамики можно сформулировать как закон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
Можно дать более краткую формулировку второго начала термодинамики: в процессах, происходящих в замкнутой системе, энтропия не убывает. Здесь существенно, что речь идет о замкнутых системах, так как в незамкнутых системах энтропия может вести себя любым образом (убывать, возрастать, оставаться постоянной). Кроме того, отметим еще раз, что энтропия остается постоянной в замкнутой системе только при обратимых процессах. При необратимых процессах в замкнутой системе энтропия всегда возрастает.
Формула
Больцмана (![]() ,
k-постоянная
Больцмана)
позволяет объяснить постулируемое
вторым началом термодинамики
возрастание энтропии в замкнутой системе
при необратимых процессах:
возрастание
энтропии означает
переход системы из
менее вероятных в более вероятные
состояния.
Таким образом, формула Больцмана
позволяет дать статистическое
толкование второго начала термодинамики.
Оно, являясь статистическим законом,
описывает закономерности хаотического
движения большого числа частиц,
составляющих
замкнутую систему.
,
k-постоянная
Больцмана)
позволяет объяснить постулируемое
вторым началом термодинамики
возрастание энтропии в замкнутой системе
при необратимых процессах:
возрастание
энтропии означает
переход системы из
менее вероятных в более вероятные
состояния.
Таким образом, формула Больцмана
позволяет дать статистическое
толкование второго начала термодинамики.
Оно, являясь статистическим законом,
описывает закономерности хаотического
движения большого числа частиц,
составляющих
замкнутую систему.
Укажем еще две формулировки второго начала термодинамики:
по Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу;
по Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
Можно довольно просто доказать (предоставим это читателю) эквивалентность формулировок Кельвина и Клаузиуса. Кроме того, показано, что если в замкнутой системе провести воображаемый процесс, противоречащий второму началу термодинамики в формулировке Клаузиуса, то он сопровождается уменьшением энтропии. Это же доказывает эквивалентность формулировки Клаузиуса (а следовательно, и Кельвина) и статистической формулировки, согласно которой энтропия замкнутой системы не может убывать.
35.Теорема Карно. Цикл Карно и его КПД для идеального газа.
Основываясь на втором начале термодинамики, Карно вывел теорему, носящую теперь его имя: из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей (Т1) и холодильников (Т2), наибольшим к. п. д. обладают обратимые машины; при этом к. п. д. обратимых машин, работающих при одинаковых температурах нагревателей (Т1) и холодильников (Т2), равны друг другу и не зависят от природы рабочего тела (тела, совершающего круговой процесс и обменивающегося энергией с другими телами), а определяются только температурами нагревателя и холодильника.
Карно теоретически проанализировал обратимый наиболее экономичный цикл, состоящий из двух изотерм и двух адиабат. Его называют циклом Карно. Рассмотрим прямой цикл Карно, в котором в качестве рабочего тела используется идеальный газ, заключенный в сосуд с подвижным поршнем.
Ц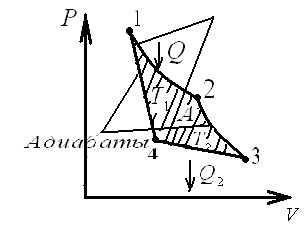 икл
Карно изображен на рис., где изотермические
расширение и сжатие заданы соответственно
кривыми 1-2
и
3-4,
а
адиабатические расширение и сжатие —
кривыми
2-3
и
4-1.
При изотермическом процессе U=const,
поэтому,
количество теплоты Q1,
полученное
газом от нагревателя, равно работе
расширения А12,
совершаемой
газом при переходе из состояния 1 в
состояние 2:
икл
Карно изображен на рис., где изотермические
расширение и сжатие заданы соответственно
кривыми 1-2
и
3-4,
а
адиабатические расширение и сжатие —
кривыми
2-3
и
4-1.
При изотермическом процессе U=const,
поэтому,
количество теплоты Q1,
полученное
газом от нагревателя, равно работе
расширения А12,
совершаемой
газом при переходе из состояния 1 в
состояние 2:
![]() (1). При
адиабатическом расширении 2-3
теплообмен
с окружающей средой отсутствует и
работа расширения А23
совершается
за счет изменения внутренней энергии
(1). При
адиабатическом расширении 2-3
теплообмен
с окружающей средой отсутствует и
работа расширения А23
совершается
за счет изменения внутренней энергии
![]()
Количество
теплоты Q2,
отданное
газом холодильнику при изотермическом
сжатии, равно работе сжатия А34:
![]() (2).
(2).
Работа
адиабатического сжатия
![]()
Работа,
совершаемая в результате кругового
процесса,
![]() и,
как можно показать, определяется
площадью, заштрихованной на рис.
Термический
к. п. д. цикла Карно,
и,
как можно показать, определяется
площадью, заштрихованной на рис.
Термический
к. п. д. цикла Карно,
![]() Применив
уравнение (
=const)
для адиабат 2-3
и
4-1,
получим
Применив
уравнение (
=const)
для адиабат 2-3
и
4-1,
получим
![]() =
=![]() ,
,
![]() =
=![]() откуда
откуда
![]() (3). Подставляя
(1) и (2) в формулу
(3). Подставляя
(1) и (2) в формулу
![]() и учитывая (3), получаем
и учитывая (3), получаем
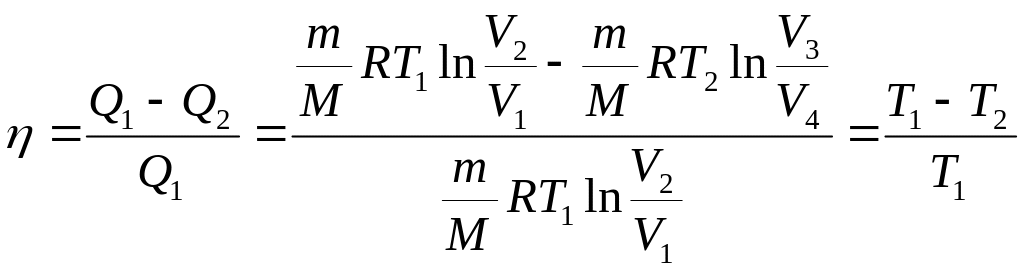 (4)
(4)
т. е. для цикла Карно к. п. д. действительно определяется только температурами нагревателя и холодильника. Для его повышения необходимо увеличивать разность температур нагревателя и холодильника.
Обратный цикл Карно положен в основу действия тепловых насосов. В отличие от холодильных машин тепловые насосы должны как можно больше тепловой энергии отдавать горячему телу, например системе отопления. Часть этой энергии, отбирается от окружающей среды с более низкой температурой, а часть — получается за счет механической работы, производимой, например, компрессором.
ВНП:
КПД идеальной тепловой машины определяется
только температурой теплоотдатчика и
теплоприемника.![]()
![]()
(![]() приведенная теплота)
приведенная теплота)
![]() неравенство
Клаудиуса.
неравенство
Клаудиуса.
