
- •1.Предмет и задачи. Методы. Теория и эксперимент.
- •Методы физического исследования: опыт, гипотеза, эксперимент, теория
- •2.Системы отсчета. Путь, перемещение, траектория материальной точки (мт).
- •3.Основные кинематические характеристики движения матер. Точки, твердого тела:
- •9)Определение деформации. Виды деформации.
- •10)Характеристики деформации. Законы Гука, модуль Юнга, графики диффузии. Энергия упр.Диффузии.
- •11.Механическая система. Импульс механической системы. Закон сохранения импульса.
- •12. Центр масс. Центр тяжести механической системы. Закон движения центра масс.
- •13.Уравнение движения тел переменной массы. Уравнение Мещерского. Уравнение Циолковского.
- •14.Энергия, работа, мощность. Кинетическая и потенциальная энергия.
- •15.Закон сохранения энергии. Графическое представление энергии.
- •16.Применение закона сохранения на примере удара абсолютно упругих и неупругих тел.
- •17.Вращательное движение абсолютно твердого тела. Момент инерции. Вычисление моментов инерции сплошного цилиндра, полого цилиндра, шара, стержня.
- •19.Момент силы. Уравнение динамики вращательного движения твердого тела.
- •20.Момент импульса. Уравнение момента. Закон сохранения закона импульса.
- •Основные задачи молекулярной физики.
- •24. Опытные законы идеального газа. Уравнения Клапейрона-Менделеева.Процесс, который проходит при постоянной температуре, называется изотермическим. , ( - масса газа )
- •25. Барометрическая формула. Распределение Больцмана.
- •28. Работа и теплота. Пнт.
- •29. Теплоёмкости. Классическая теория теплоёмкостей. Закон Джоуля.
- •36. Энтропия. Свойства энтропии, изменение энтропии при изопроцессах.
- •41. Теплопроводность в газах
- •42.Соотношение между коэффициентами диффузии ( ), теплопроводности ( ) и вязкости ( ).
- •44. Напряженность электростатического поля.
- •2)Поле конденсатора
- •50. Поле объемно заряженного шара.
- •51. Диполь в электрическом поле
- •52. Циркуляция вектора напряжённости е эл.Поля
- •53. Потенциал электростатического поля.
- •54. Напряжённость как градиент потенциала.
- •55. Потенциал в простейших электрических полях.
- •56. Электроёмкость уединённого проводника.
- •57. Электроёмкость простых конденсаторов.
- •60. Энергия электростатического поля.
- •63. Сторонние силы. Электродвижущая сила и напряжение.
- •64. Закон Ома для однородного участка цепи. Сопротивление проводников. Последовательное и параллельное соединение проводников.
- •66. Закон Ома в дифференциальной форме и для неоднородного участка цепи.
- •67. Разветвлённые цепи. Правила Кирхгофа для разветвлённых цепей.
24. Опытные законы идеального газа. Уравнения Клапейрона-Менделеева.Процесс, который проходит при постоянной температуре, называется изотермическим. , ( - масса газа )
![]() ,
,
![]() ,
,
![]()
![]() .
.
Закон идеального газа (Бойля-Мариотта)
Для данной массы газа при постоянной температуре произведение давления на его объем есть величина постоянная.
Закон Гейлюсака:
![]() .
.
Процесс, протекающий при постоянном давлении, называется изобарным.
![]()
![]() ,
,
![]() ,
,
![]()
![]()
![]()
![]()

Д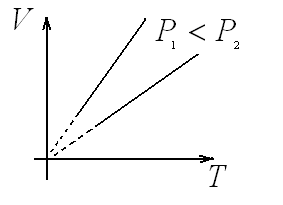 ля
данной массы газа при постоянном давлении
отношение объема к абсолютной температуре
есть величина постоянная.
ля
данной массы газа при постоянном давлении
отношение объема к абсолютной температуре
есть величина постоянная.
![]()
![]()
![]()
![]() (
(![]() коэффициент объемного расширения)
коэффициент объемного расширения)
![]()
![]()
![]()
![]() ,
,
![]()
![]() -
процесс изохорный Для данной массы
газа при постоянном объеме отношение
давления к абсолютной температуре есть
величина постоянная.
-
процесс изохорный Для данной массы
газа при постоянном объеме отношение
давления к абсолютной температуре есть
величина постоянная.

![]() -термический
коэффициент давления.
-термический
коэффициент давления.
![]() .
.
Объединенный газовый закон.
![]()
![]()
Произведение давление газа на его объем, отнесенное к абсолютной температуре, для данной массы газа есть величина постоянная.
Закон Авогадро.
![]()
![]() ,
,
Наложим
условие:
![]() , но различные газы. 1.
, но различные газы. 1.![]() 1.
1.
![]()
2.
![]() 2.
2.
![]()
где
(![]() ,
,
![]() ),
),
![]() ,
так как
,
так как
![]()
![]() ,
,
![]() ,
,
В одинаковых объемах, при одинаковых температурах и давлениях содержится одинаковое количество молекул.
![]() моль
моль![]() - число Авогадро.
- число Авогадро.
Закон Дальтона.
![]() ,
где
,
где
![]() -
энергия поступательного движения одной
молекулы.
-
энергия поступательного движения одной
молекулы.
![]() -
обще
число
молекул.
-
обще
число
молекул.
![]() ,
,
![]()
![]() эта
формула выражает закон Дальтона.
эта
формула выражает закон Дальтона.
![]() -
парциальное давление – давление, которое
оказывал бы этот газ, если бы он один
занимал весь объем, занимаемый смесью.
-
парциальное давление – давление, которое
оказывал бы этот газ, если бы он один
занимал весь объем, занимаемый смесью.
Давление смеси газов равно сумме парциальных давлений.
![]()
![]()
![]()
![]() ;
;
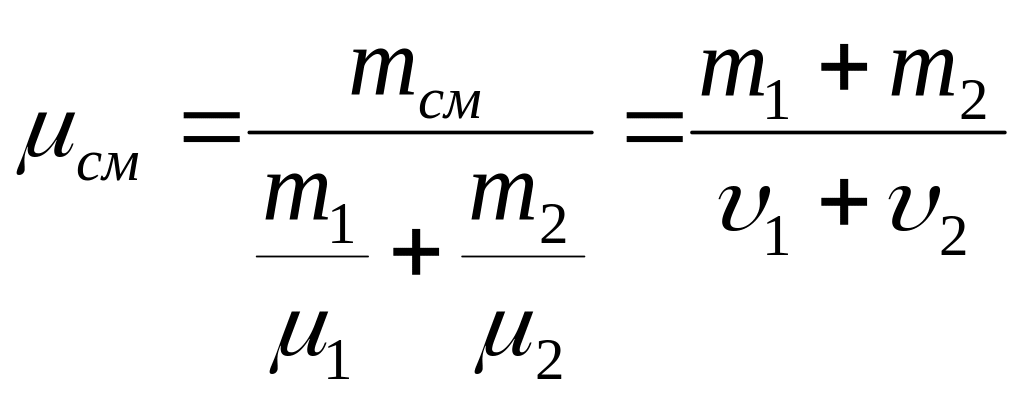 .
.
Закон Дальтона не выполняется для химических активных газов и при высоких давлениях.
Уравнение
состояние имеет вид:
![]()
![]()
![]() ,
(где
,
(где
![]() ),
тогда
),
тогда
![]()
![]() -
молярная постоянная.
-
молярная постоянная.
![]()
![]() -
унерсальная газавая постояная.
-
унерсальная газавая постояная.
![]()
![]()
![]() -
величина,
численно равная работе расширения
одного моля идеального газа при его
нагревании на 1 Кельвин при постоянным
давлении.
-
величина,
численно равная работе расширения
одного моля идеального газа при его
нагревании на 1 Кельвин при постоянным
давлении.
![]() ,
,
![]() - величина, численно равная отношению
работы по расширению одного моля газа
при постоянном давлении и нагревании
на 1 К к числу молекул, содержащихся в 1
моле.
- величина, численно равная отношению
работы по расширению одного моля газа
при постоянном давлении и нагревании
на 1 К к числу молекул, содержащихся в 1
моле.
![]()
или
![]()
![]() ,
,
![]()
![]()
![]() ,
,
![]() ,
,
![]() ,
,
![]()
![]() -
для идеального газа.
-
для идеального газа.
Средняя
кинетич. энергия
поступательного движения одной молекулы
пропорционально
![]() ,
и зависит только от нее. Из этого следует,
что
с точность до постоянного множителя
,
и зависит только от нее. Из этого следует,
что
с точность до постоянного множителя
![]() равной средней кинетич. энергии
поступательного движения одной молекулы
идеального газа. Отсюда следует, что
при
равной средней кинетич. энергии
поступательного движения одной молекулы
идеального газа. Отсюда следует, что
при
![]() , т.е при
, т.е при
![]() прекращается поступательного движения
молекул газа, а следовательно, его
давление равно 0. Таким образом,
термодинамич. температура является
мерой средней кинет. энергии поступательного
движения молекул идеального газа.
прекращается поступательного движения
молекул газа, а следовательно, его
давление равно 0. Таким образом,
термодинамич. температура является
мерой средней кинет. энергии поступательного
движения молекул идеального газа.
25. Барометрическая формула. Распределение Больцмана.
П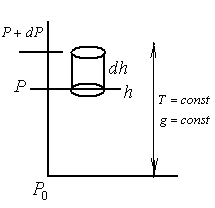 ри
ри
![]() .
Пусть площадь цилиндра равна 1,
.
Пусть площадь цилиндра равна 1,
![]() выбрали так, что бы
выбрали так, что бы
![]() было равно const
для
было равно const
для
![]() .
.
![]() -вес
воздуха, заключенном в объеме цилиндра.
-вес
воздуха, заключенном в объеме цилиндра.
![]() ,
,
![]() ,
,
,
,
![]()
![]() -масса
Земли,
-масса
Земли,
![]() -
расстояние от центра Земли.
-
расстояние от центра Земли.
![]()
![]()
![]() ,
,
![]()
![]()
![]() -Барометрическая
формула.
-Барометрическая
формула.
![]()
![]() -
распределение Больцмана,
-
распределение Больцмана,
где
-
концентрация молекул на высоте
![]() ,
,
![]() -
то же, на высоте
-
то же, на высоте
![]() .
.
Т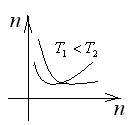 ак
как
(
ак
как
(![]() -постоянная Авогадро,
- масса одной молекулы), а
-постоянная Авогадро,
- масса одной молекулы), а
![]() ,
то где
,
то где
![]() -потенциальная энергия молекулы в поле
тяготения, т.е
-потенциальная энергия молекулы в поле
тяготения, т.е
![]() - распределение Больцмана.
- распределение Больцмана.
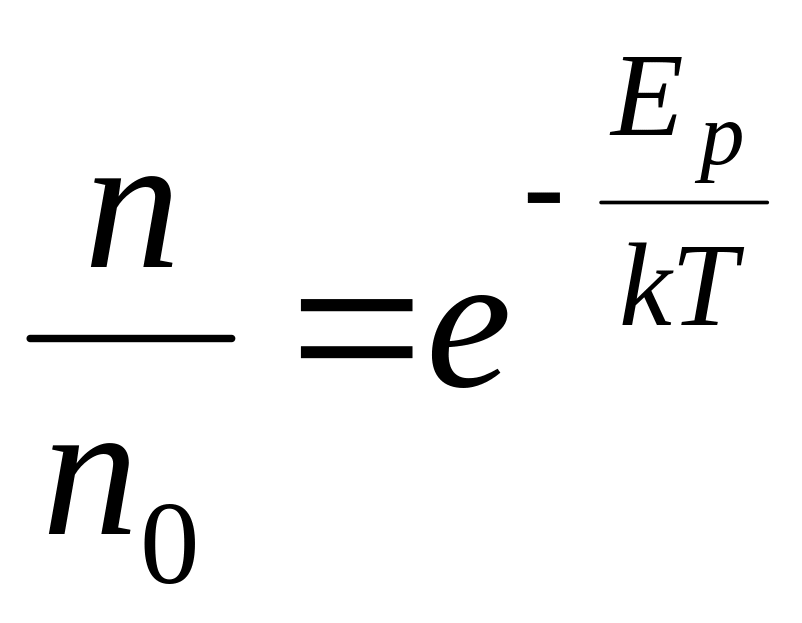 .
Существует в атмосфере распределение
молекул воздуха по высоте устанавливаются
в результате действия двух факторов:
.
Существует в атмосфере распределение
молекул воздуха по высоте устанавливаются
в результате действия двух факторов:
под действием силы тяжести молекул стремятся опуститься на поверхность Земли;
тепловое движение, характеризуемое величиной КТ, стремиться распределить молекулы равномерно по высотам.
Формула определяет распределение молекул по высоте и выражает также распределение их по значениям потенц. энергии. Этот закон распределения молекул по значениям потенц. энергии справедлив не только для поля силы тяжести, но и для любого поля потенциальных сил.
26. Опытное обоснование
МКТ
(опыт Штерна, броуновское движение,
опытное определение постоянной Авогадро).
Опыт Штерна. Опыты Штерна позволили
также оценить распределение молекул
по скоростям. Схема установки Штерна
представлена на рис.1.З ная
радиусы цилиндров, их угловую скорость
вращения, а также измеряя
ная
радиусы цилиндров, их угловую скорость
вращения, а также измеряя
![]() ,
можно вычислить скорость движения
атомов серебра при данной температуре
проволоки. Броуновское движение.
,
можно вычислить скорость движения
атомов серебра при данной температуре
проволоки. Броуновское движение.
Броун, наблюдая под микроскопом взвесь цветочной пыльцы в воде, обнаружил, что частицы пыльцы оживленно и беспорядочно двигались, то перемещаясь с места на место, подобно пылинкам в солнечном луче. Интенсивность этого движения, называемого броуновским. Броуновское движение взвешенных частиц вызывается ударами молекул среды, в которой частицы взвешены. Так как молекулы движутся хаотически, то броуновские частицы получают толчки с разных сторон, поэтому и совершают движение столь причудливой формы. Таким образом, броуновское движение является подтверждением выводов молекулярно-кинетической теории о хаотическом движением атомов и молекул.
Опытное
определение постоянной Авогадро.
Исследуя под микроскопом броуновское
движение, Ж. Перрен убедился, что
броуновские частицы распределяются по
высоте подобно молекулам газа в поле
тяготения. Применив к ним больцмановское
распределение, можно записать
![]() где (
где (![]() -
масса частицы,
-
масса частицы,
![]() -
масса вытесненной ею жидкости),
-
масса вытесненной ею жидкости),
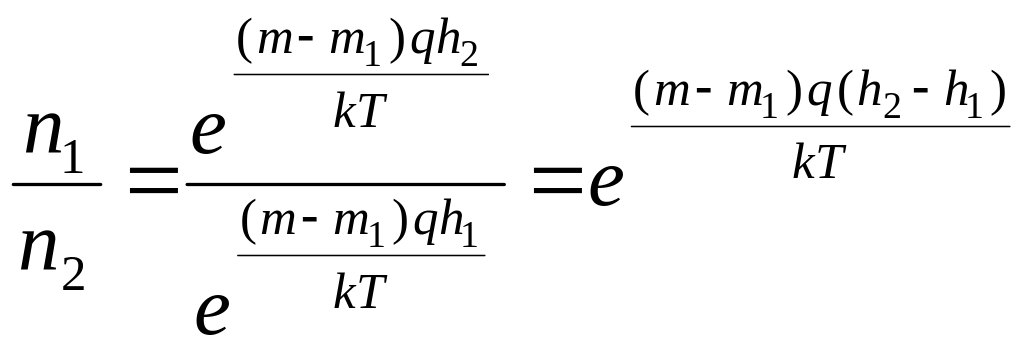
![]()
![]() ,
,
![]() где (
-
радиус частиц,
-
плотность частиц,
где (
-
радиус частиц,
-
плотность частиц,
![]() -
плотность жидкости).
-
плотность жидкости).
![]() ,
,
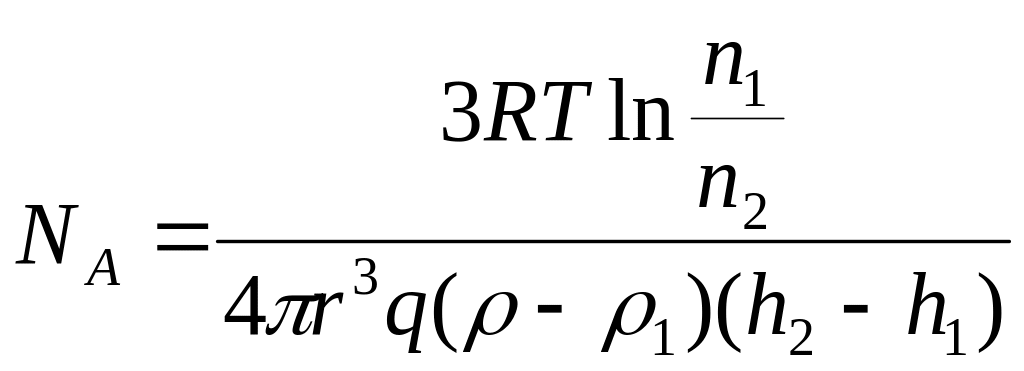 .
.
2 7.
Внутренняя энергия. Закон Больцмана о
равномерном распределении энергии по
степеням свободы молекул
Атомы реального газа взаимодействуют
между собой. Они обладают кинет. и потенц.
энергией. Внутренняя энергия тела есть
сумма всех видов энергии, заключается
в изолированной системе, за исключением
энергии, которая система обладает в
результате с другими телами(потенц. и
кинет. энергии самой системы).
7.
Внутренняя энергия. Закон Больцмана о
равномерном распределении энергии по
степеням свободы молекул
Атомы реального газа взаимодействуют
между собой. Они обладают кинет. и потенц.
энергией. Внутренняя энергия тела есть
сумма всех видов энергии, заключается
в изолированной системе, за исключением
энергии, которая система обладает в
результате с другими телами(потенц. и
кинет. энергии самой системы).
![]()
1 –атомная молекула обладает тремя
степенями свободы; 2 –атомная –3 степени
свободы поступ. движения, 2степени вращ.
движения; 3 и больше 6 –степеней свободы.
–атомная молекула обладает тремя
степенями свободы; 2 –атомная –3 степени
свободы поступ. движения, 2степени вращ.
движения; 3 и больше 6 –степеней свободы.
![]()
Для
статической системы, находящ. в состоянии
термодин. равновесия, на каждую
поступательной и вращательной степени
свободы приходится в среднем кинетич.
энергия
![]() , а на каждое колебание степень свободы
–
, а на каждое колебание степень свободы
–![]() .
.
![]() ,
,
![]() .
.
Колебание движение всегда связано с переходам кинетической энергии в потенциальную и наоборот, поэтому при учете энергии колебание атомов в молекуле невозможно отделить 1 вид энергии от 2-ого.
Тогда необходимо учитывать и соотв. потенц. энергию. Колеб. степень свободы обладает вдоль большей энергией, потому, что на нее приходится не только кинет. энергия, но и потенц. энергия, энергии одинаковы.
![]()
![]()
![]() ,
,
![]() ,
,
![]()
Внутренняя энергия есть функция состояния.
![]()
![]()
Это означает, что интеграл не зависит от пути интегрирования, а его подынтегральное выражение является полным дифференциалом.
