
- •1.Предмет и задачи. Методы. Теория и эксперимент.
- •Методы физического исследования: опыт, гипотеза, эксперимент, теория
- •2.Системы отсчета. Путь, перемещение, траектория материальной точки (мт).
- •3.Основные кинематические характеристики движения матер. Точки, твердого тела:
- •9)Определение деформации. Виды деформации.
- •10)Характеристики деформации. Законы Гука, модуль Юнга, графики диффузии. Энергия упр.Диффузии.
- •11.Механическая система. Импульс механической системы. Закон сохранения импульса.
- •12. Центр масс. Центр тяжести механической системы. Закон движения центра масс.
- •13.Уравнение движения тел переменной массы. Уравнение Мещерского. Уравнение Циолковского.
- •14.Энергия, работа, мощность. Кинетическая и потенциальная энергия.
- •15.Закон сохранения энергии. Графическое представление энергии.
- •16.Применение закона сохранения на примере удара абсолютно упругих и неупругих тел.
- •17.Вращательное движение абсолютно твердого тела. Момент инерции. Вычисление моментов инерции сплошного цилиндра, полого цилиндра, шара, стержня.
- •19.Момент силы. Уравнение динамики вращательного движения твердого тела.
- •20.Момент импульса. Уравнение момента. Закон сохранения закона импульса.
- •Основные задачи молекулярной физики.
- •24. Опытные законы идеального газа. Уравнения Клапейрона-Менделеева.Процесс, который проходит при постоянной температуре, называется изотермическим. , ( - масса газа )
- •25. Барометрическая формула. Распределение Больцмана.
- •28. Работа и теплота. Пнт.
- •29. Теплоёмкости. Классическая теория теплоёмкостей. Закон Джоуля.
- •36. Энтропия. Свойства энтропии, изменение энтропии при изопроцессах.
- •41. Теплопроводность в газах
- •42.Соотношение между коэффициентами диффузии ( ), теплопроводности ( ) и вязкости ( ).
- •44. Напряженность электростатического поля.
- •2)Поле конденсатора
- •50. Поле объемно заряженного шара.
- •51. Диполь в электрическом поле
- •52. Циркуляция вектора напряжённости е эл.Поля
- •53. Потенциал электростатического поля.
- •54. Напряжённость как градиент потенциала.
- •55. Потенциал в простейших электрических полях.
- •56. Электроёмкость уединённого проводника.
- •57. Электроёмкость простых конденсаторов.
- •60. Энергия электростатического поля.
- •63. Сторонние силы. Электродвижущая сила и напряжение.
- •64. Закон Ома для однородного участка цепи. Сопротивление проводников. Последовательное и параллельное соединение проводников.
- •66. Закон Ома в дифференциальной форме и для неоднородного участка цепи.
- •67. Разветвлённые цепи. Правила Кирхгофа для разветвлённых цепей.
Основные задачи молекулярной физики.
Исследование строения вещества и его изменения под влиянием внешних воздействий.
Изучение явлений переноса диффузии, теплопроводности, вязкости (внутр. трения).
Изучение газовых превращений – испарения и конденсации, плавления и кристаллизации.
Исследование критических состояний вещества.
Исследование поверхностных явлений на границах раздела баз.
22. Основные положения молекулярно-кинетической теории газов (МКТ) . Модель идеального газа.
Основные положения МКТ.
Все вещества состоят из огромного числа частиц: молекул, атомов, ионов. Линейные размеры этих частиц порядка ангстрема (10-10М).
Молекулы находятся в тепловом движении. Средняя кинетическая энергия этого движения определяет температуру тела.
Между молекулами действуют силы взаимодействия, которые в зависимости от расстояния между частицами будут силами притяжения или отталкивания.
Эти положения можно сформулировать таким образам:
Полная хаотичность движений.
Пропорциональность средней квадратичной скорости молекул корню квадратному из абсолютной температуры.
Средние кинет. энергии молекул равных газов, находится при одинаковой температуре, равна между собой.
![]()
Моль – количество вещества, содержащее столько молекул, сколько атомов содержится в 12г изотопа углерода 12С.
![]() ,
,![]() нормальная
сила.
нормальная
сила.
Температура тела – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
Модель идеального газа.
Собственный объем молекул газа пренебрежимо мал по сравнениюс объемомсосуда.
Междумолекулами газа отсуствуют силы взаимодействия.
Столкновеения молекул газа между собой и со стенками сосуда абсолютно упругие.
23. Основные уравнения МКТ идеальных газов.
Для
вывода основного уравнения МКТ рассмотрим
одноатомный идеальный газ. Молекулы
газа движутся хаотически, число взаимных
столкновений между молекулами газа
пренебрежимо малот по сравнению с числом
ударов о стенки сосуда, а соударения
молекул со стенками сосуда абсолютно
упругие. Выделим на стенке сосуда
некоторую элементарную площадку
![]() и вычислимдавление, оказываемое наэту
площадку.
и вычислимдавление, оказываемое наэту
площадку.
|
При каждом соударении
молекула, движущаяся
перпендикулярно площадке,
передает ей импульс
![]() ,
где
,
где
![]() -- масса молекулы,
-- масса молекулы,
![]() -- ее скорость. За время
-- ее скорость. За время
![]() площадки
достигнут только те молекулы, которые
заключены в объеме цилиндра с основанием
площадки
достигнут только те молекулы, которые
заключены в объеме цилиндра с основанием
![]() и
высотой
и
высотой
![]() .
Число этих молекул равно
.
Число этих молекул равно
![]() (
(![]() -- концентрация молекул). Для упрощения
расчетов хаотическое движение молекул
заменяют движением вдоль трех взаимно
перпендикулярных направлений, так что
в любой момент времени вдоль каждого
из них движется
-- концентрация молекул). Для упрощения
расчетов хаотическое движение молекул
заменяют движением вдоль трех взаимно
перпендикулярных направлений, так что
в любой момент времени вдоль каждого
из них движется
![]() молекул, причем половина молекул
молекул, причем половина молекул
![]() движется вдоль данного направления в
одну сторону, половина – в противоположную.
Тогда число ударов молекул, движущихся
в заданном направлении, о площадку
будет
движется вдоль данного направления в
одну сторону, половина – в противоположную.
Тогда число ударов молекул, движущихся
в заданном направлении, о площадку
будет
![]() .
При столкновении с площадкой эти молекулы
передадут ей импульс
.
При столкновении с площадкой эти молекулы
передадут ей импульс
![]() .
.
Тогда
давление газа, оказываемое им на стенку
сосуда,
![]() .
(1)
.
(1)
Если
газ в объеме V
содержит N
молекул, движущихся со скоростями
![]() то целесообразно рассматривать среднюю
квадратичную скорость
то целесообразно рассматривать среднюю
квадратичную скорость
![]() ,
(2) характеризующую
всю совокупность молекул газа.
,
(2) характеризующую
всю совокупность молекул газа.
Уравнение
(1) с учетом (2) примет вид
![]() .
(3)
.
(3)
Выражение (3) называется основным уравнением молекулярно-кинетической теории идеальных газов.
Учитывая,
что
![]() ,
получим
,
получим
![]() , (4)
, (4)
или
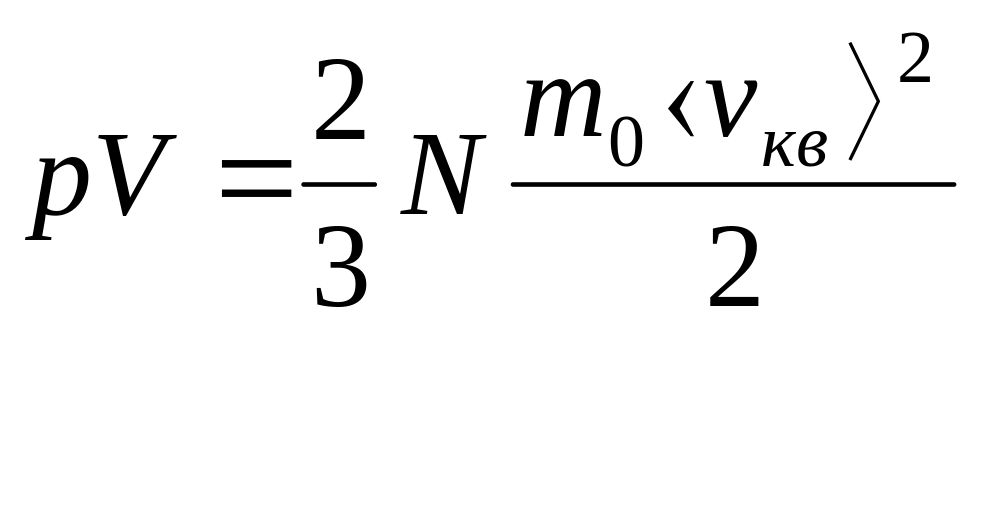 ,
,
![]() ,
где
E
–суммарная кинетическая энергия
поступательного движения всех молекул
газа. Давления
газа равна
,
где
E
–суммарная кинетическая энергия
поступательного движения всех молекул
газа. Давления
газа равна
![]() средней кинетической энергиипоступального
движения молекул, содержащихся в единице
объема газа.
средней кинетической энергиипоступального
движения молекул, содержащихся в единице
объема газа.

